1C 2023/2024
Atlante – Bombetti – Processi stocastici
30 e 31 Maggio
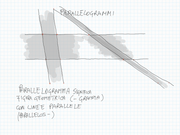
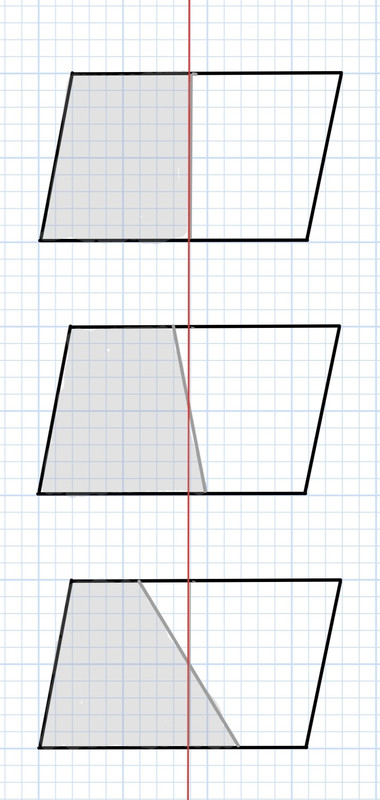
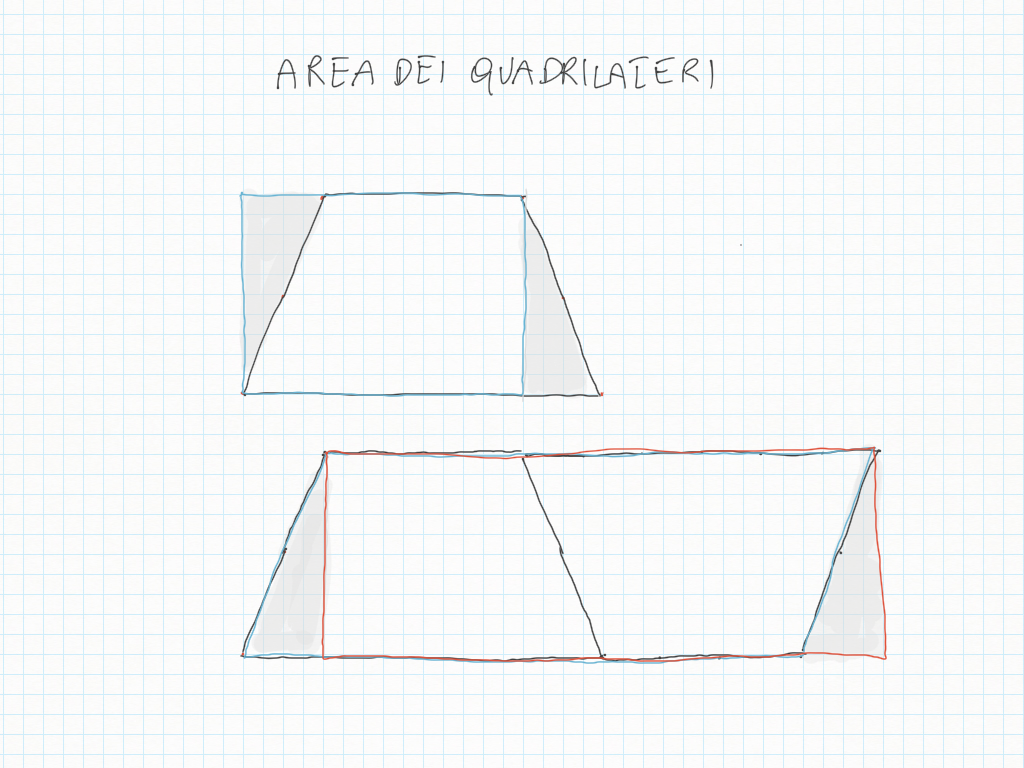
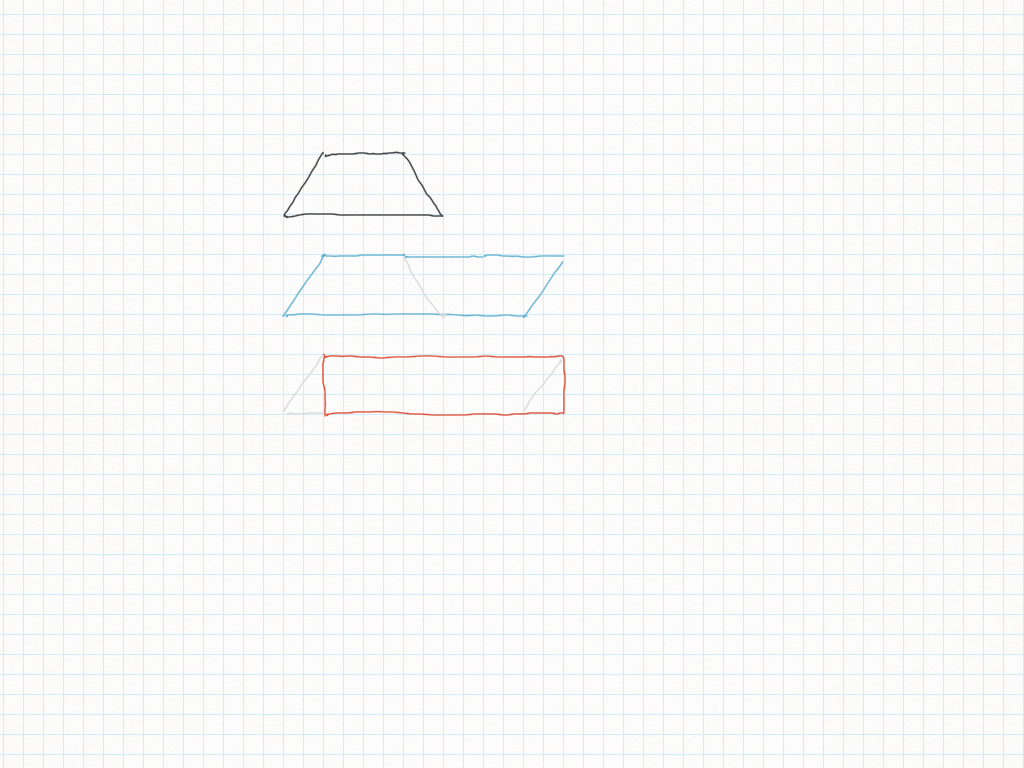
Un trapezio è sempre la metà di un parallelogramma:
28 Maggio
21 e 17 Maggio
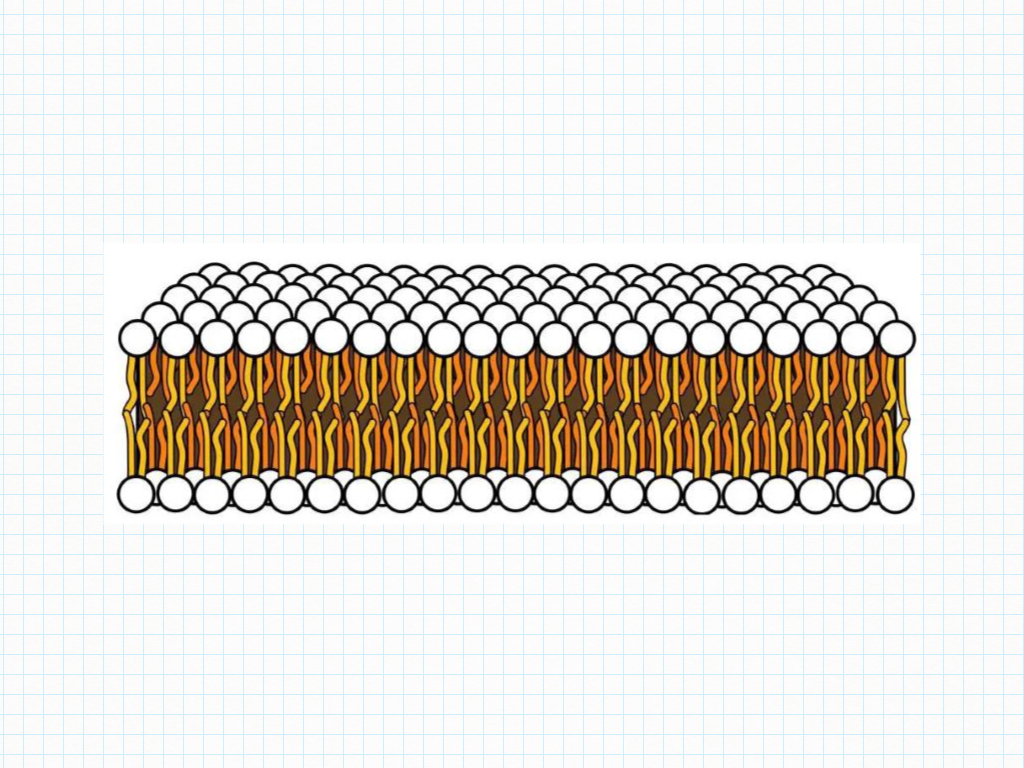
Membrane Cellulari – Il doppio strato lipidico
La membrana cellulare
20 Maggio
16 Maggio
Matematica
Esercizio valutato
Scienze
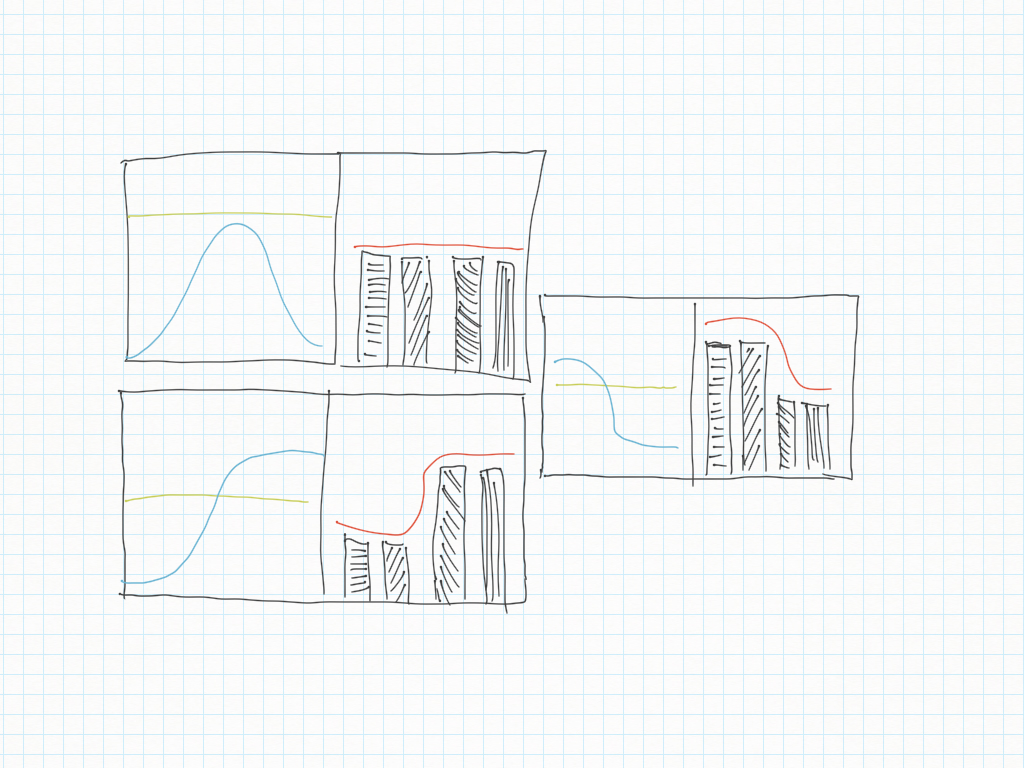
Forme micro e macroscopiche degli equilibri
“palline”
reazioni chimiche con equilibrio: simmetriche, spostate a destra, spostate a sinistra
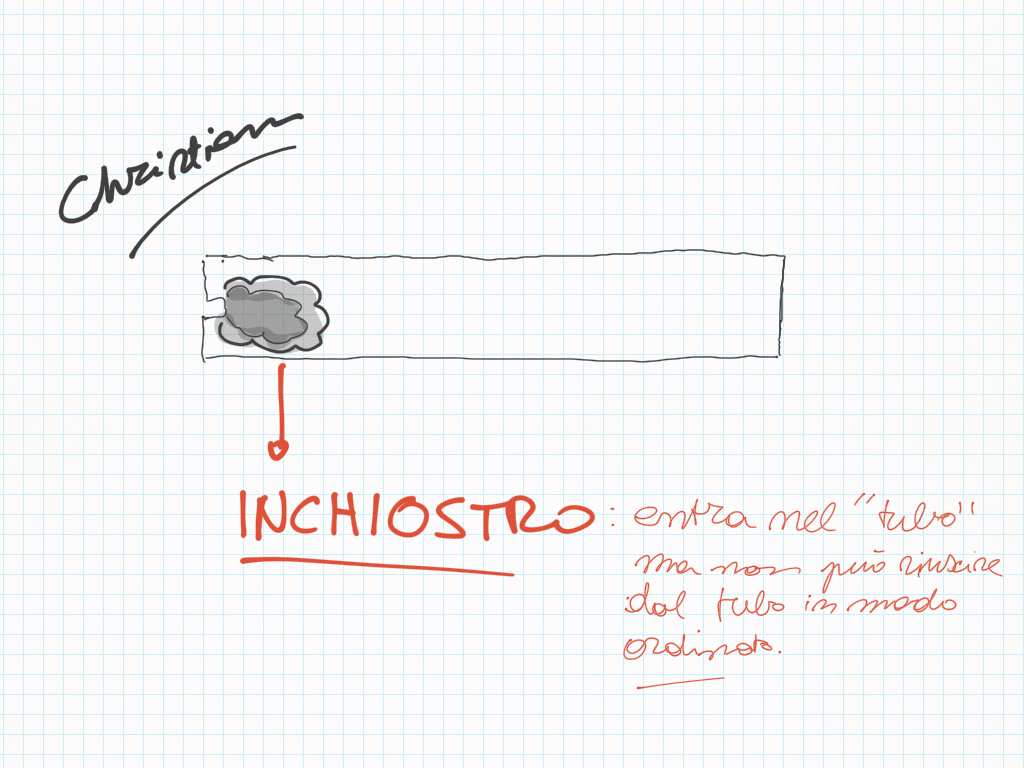
reazioni irreversibili (diffusione di inchiostro)
14 Maggio
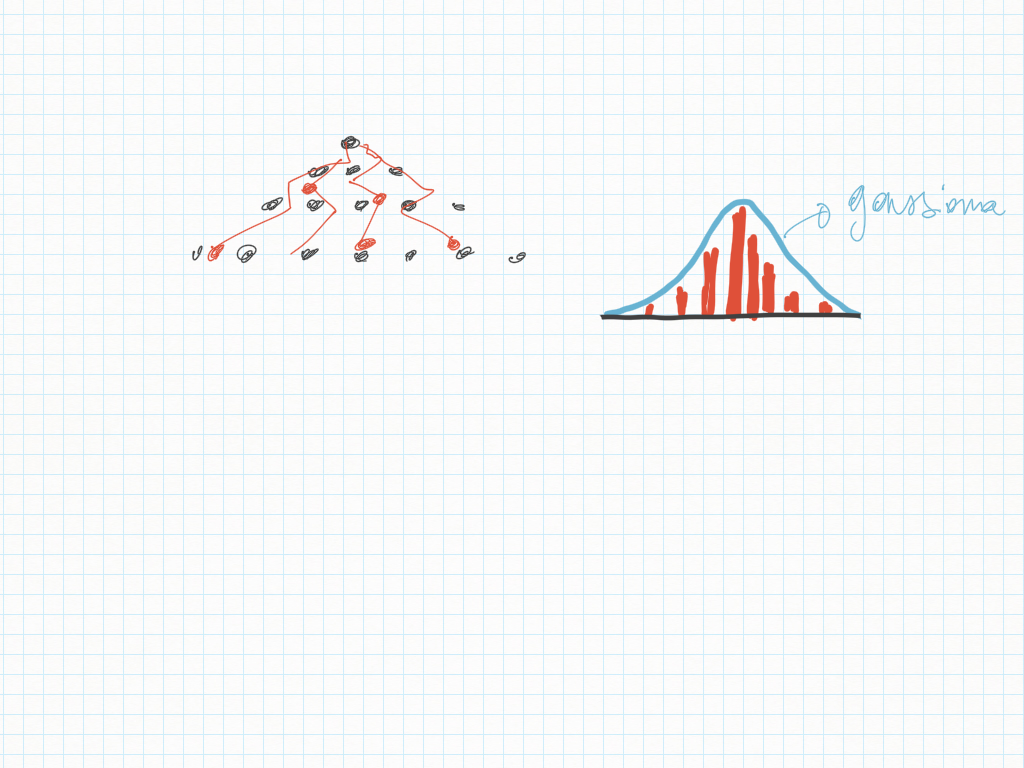
Dai processi stocastici al “vivo”
- a livello microscopico i processi sono casuali, perciò appaiono senza forma;
- a livello macroscopico no: a livello macroscopico la casualità assume una forma;
- questa forma può avere equilibrio;
- l'equilibrio può essere sia reversibile che irreversibile (non reversibile).
- le forme disordinate sono spontanee;
- le forme ordinate non sono spontanee;
Le forme di vita rimangono in vita finché sono ordinate: questo richiede che siano isolate dall'ambiente che le circonda.
13 Maggio
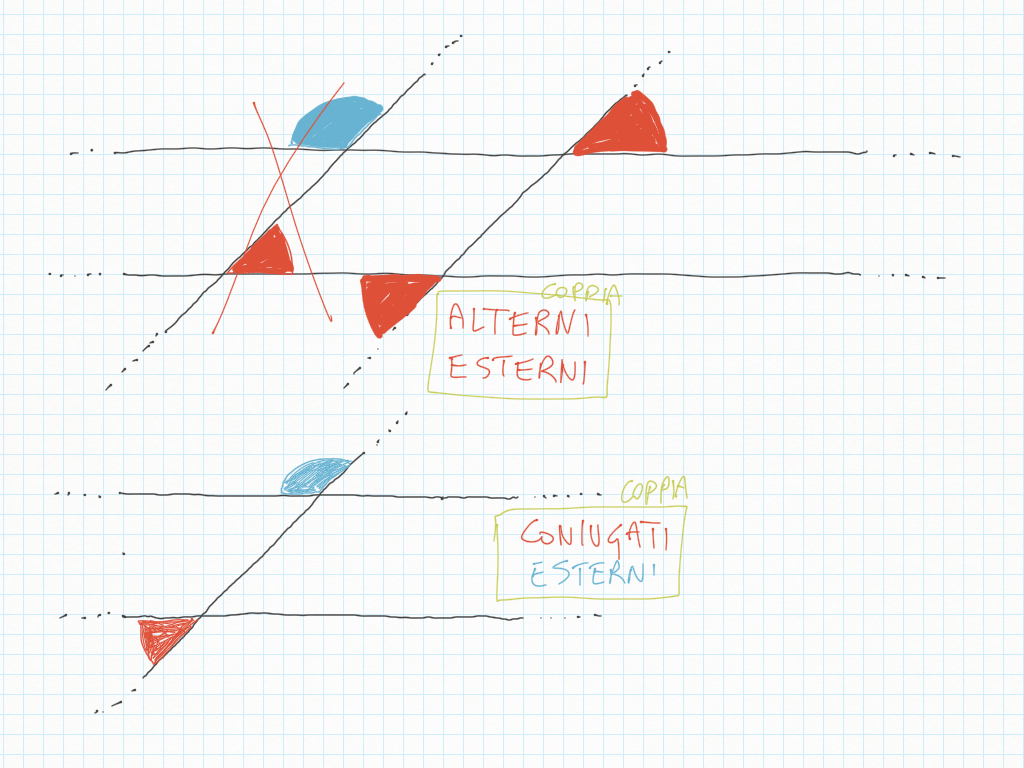
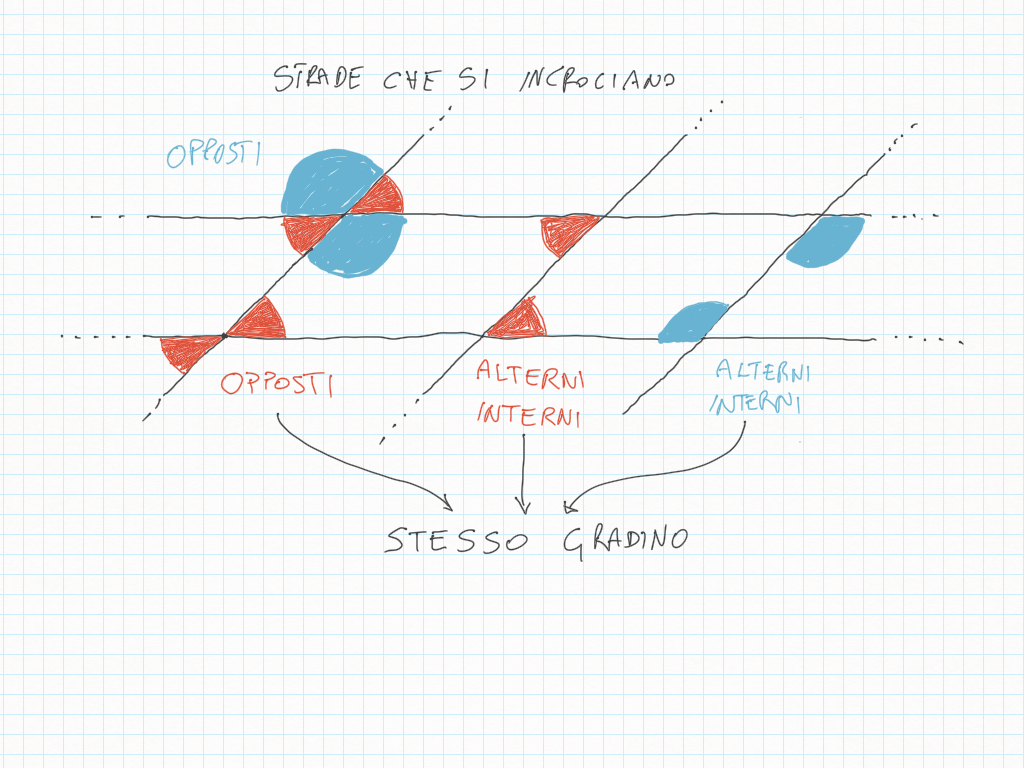
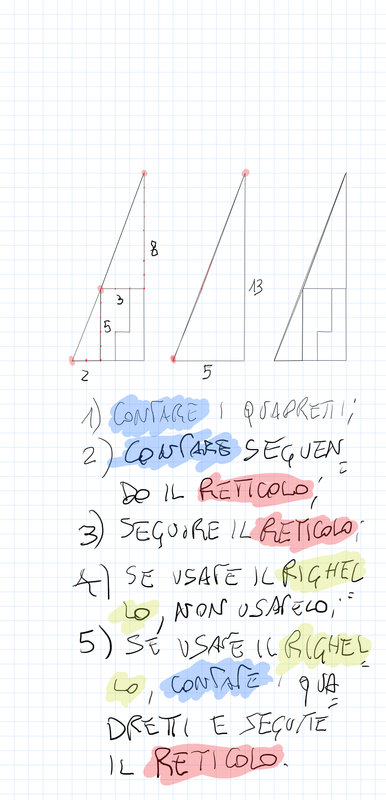
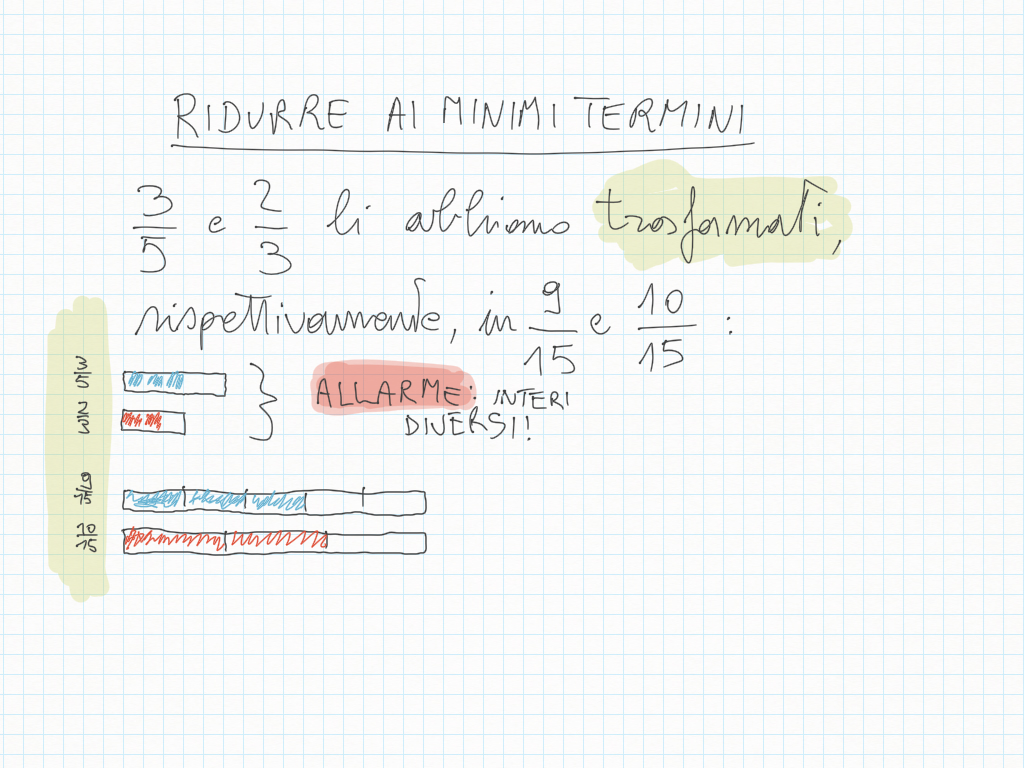
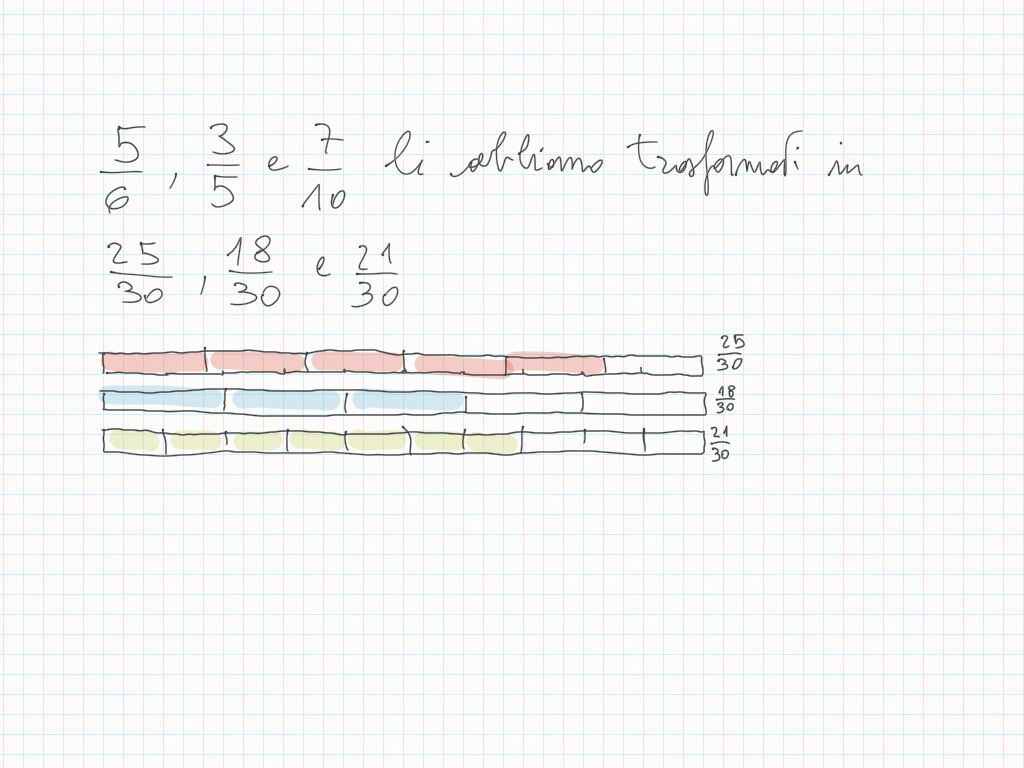
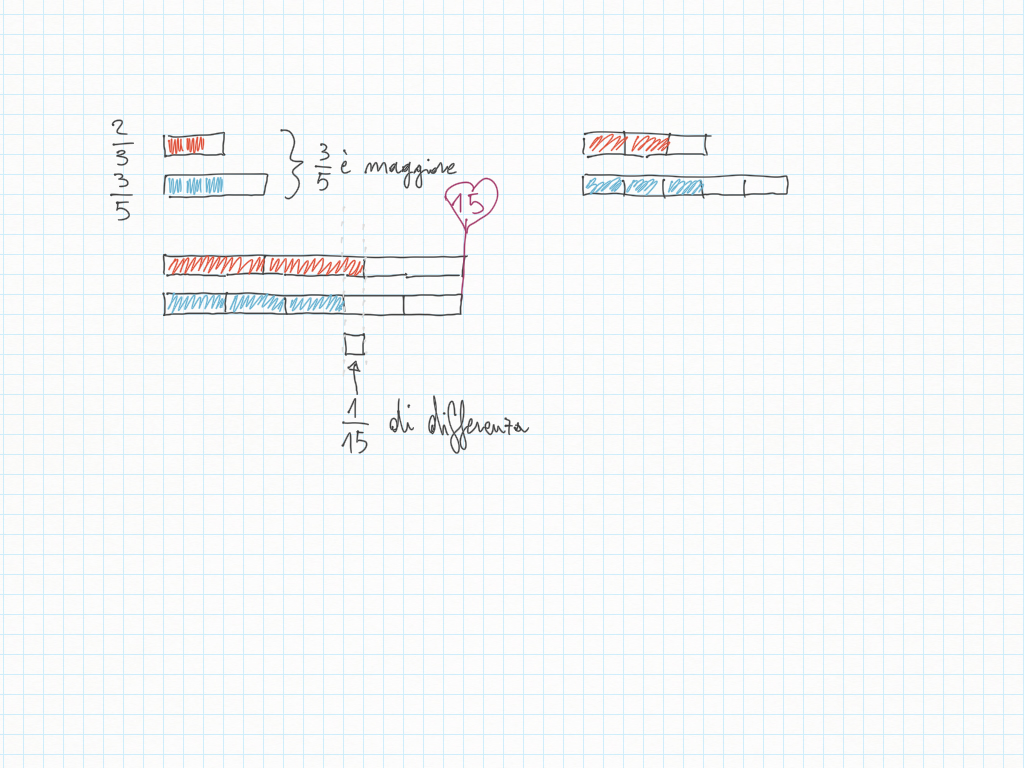
Quando disegnate rette seguite i loro gradini, perché ad ogni gradino corrisponde un angolo.
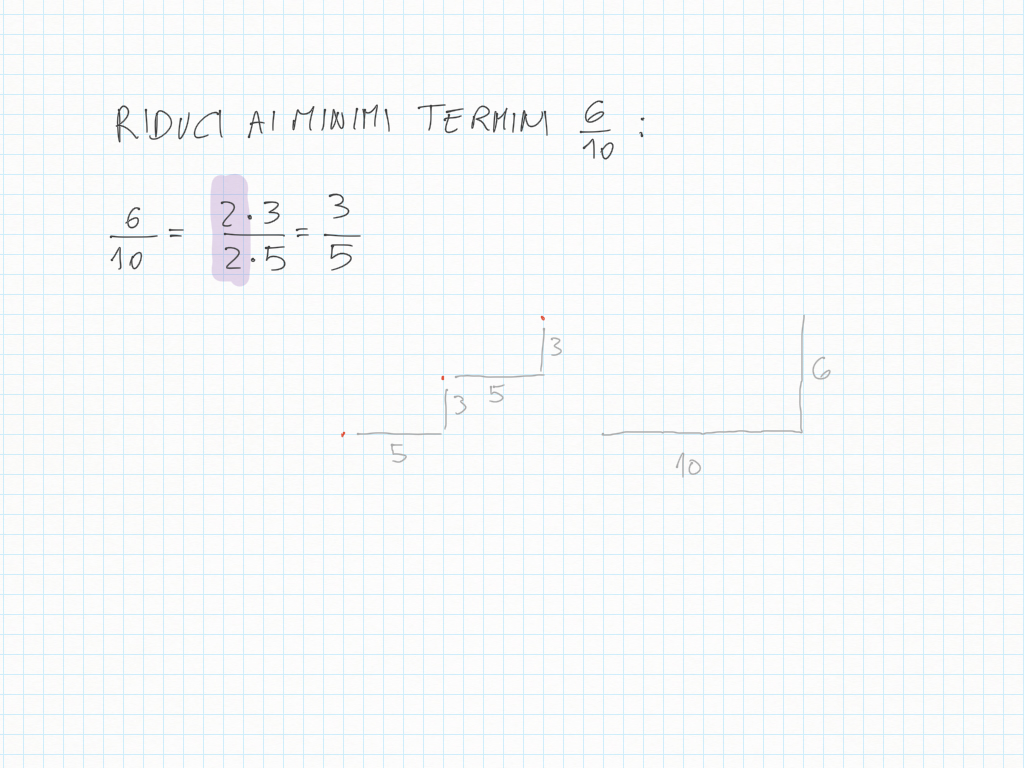
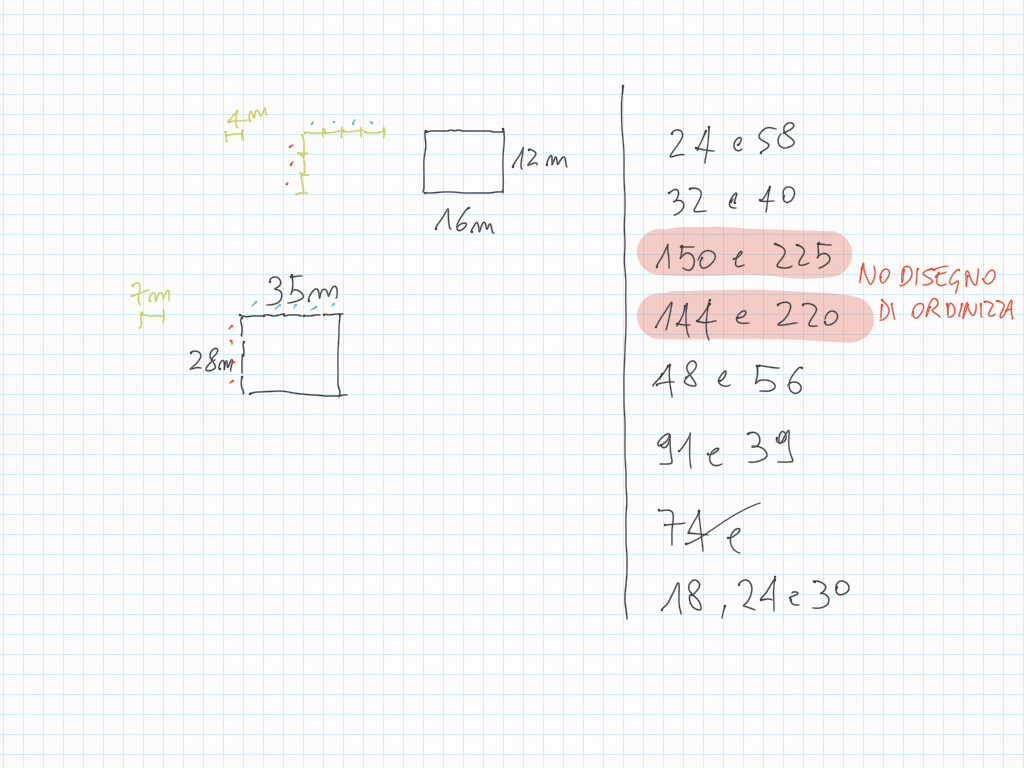
Inoltre, importante, ogni gradino può essere ridotto ai minimi termini: magari due gradini sembrano diversi – come ad esempio 20/30 e 10/15 – ma sono il medesimo! Per ridurre ai minimi termini dobbiamo utilizzare MCD.
Qui sotto un altro esempio.
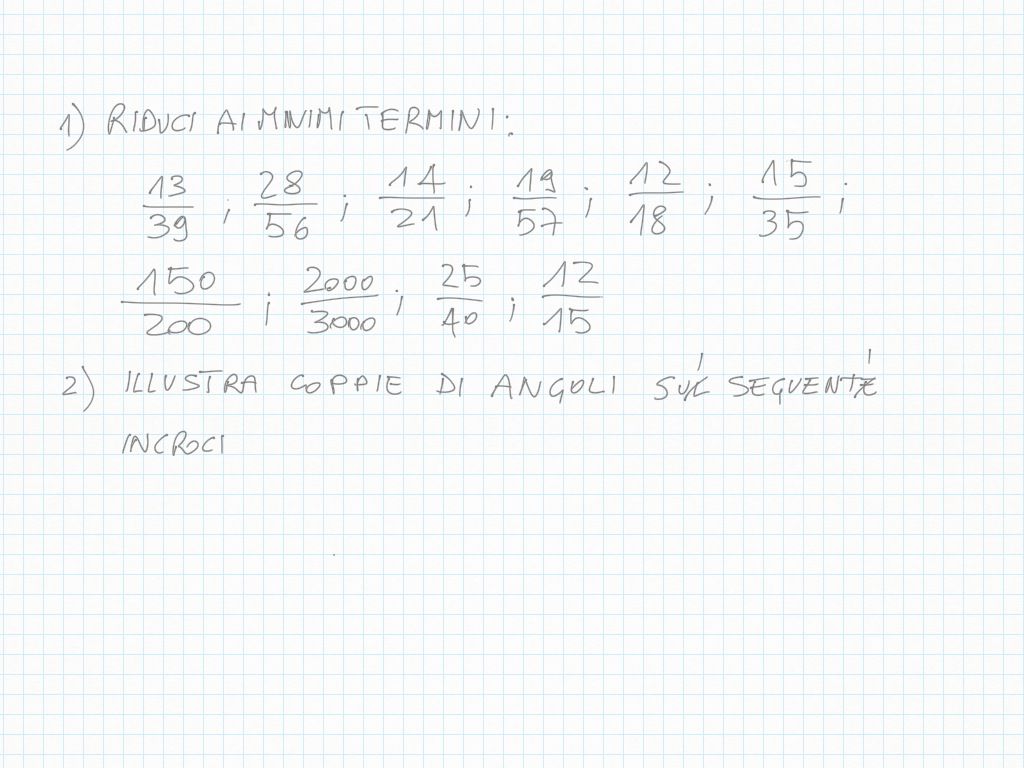
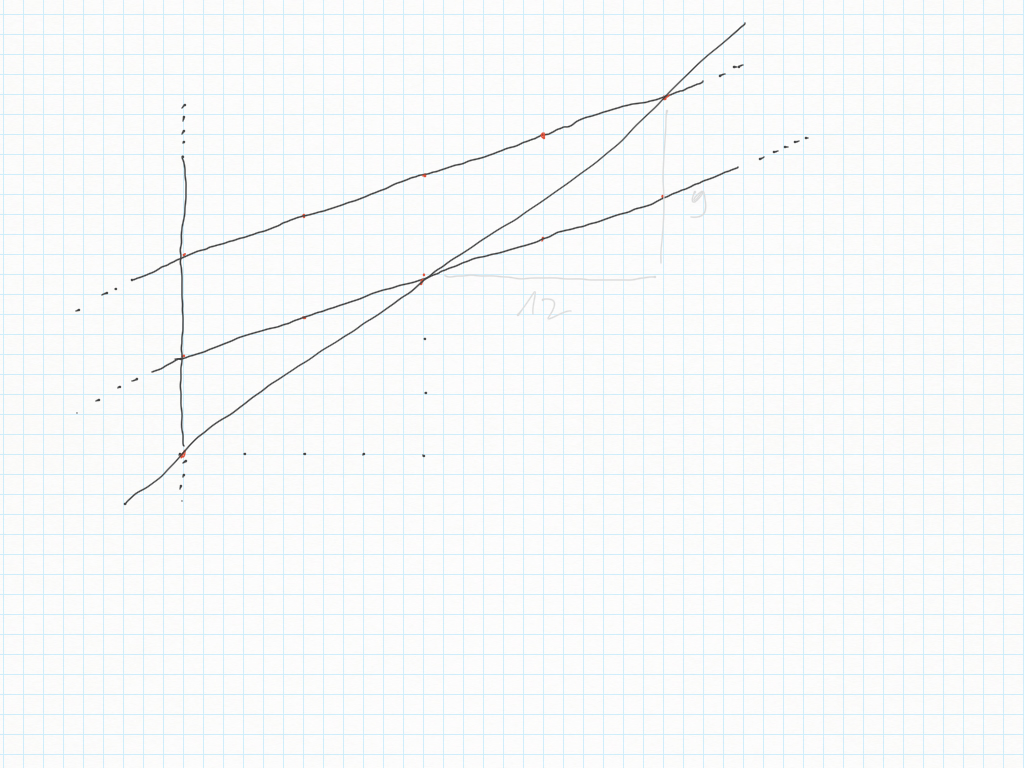
immagini prese da qui: https://telegra.ph/1C---13-Maggio-05-13
8 Maggio
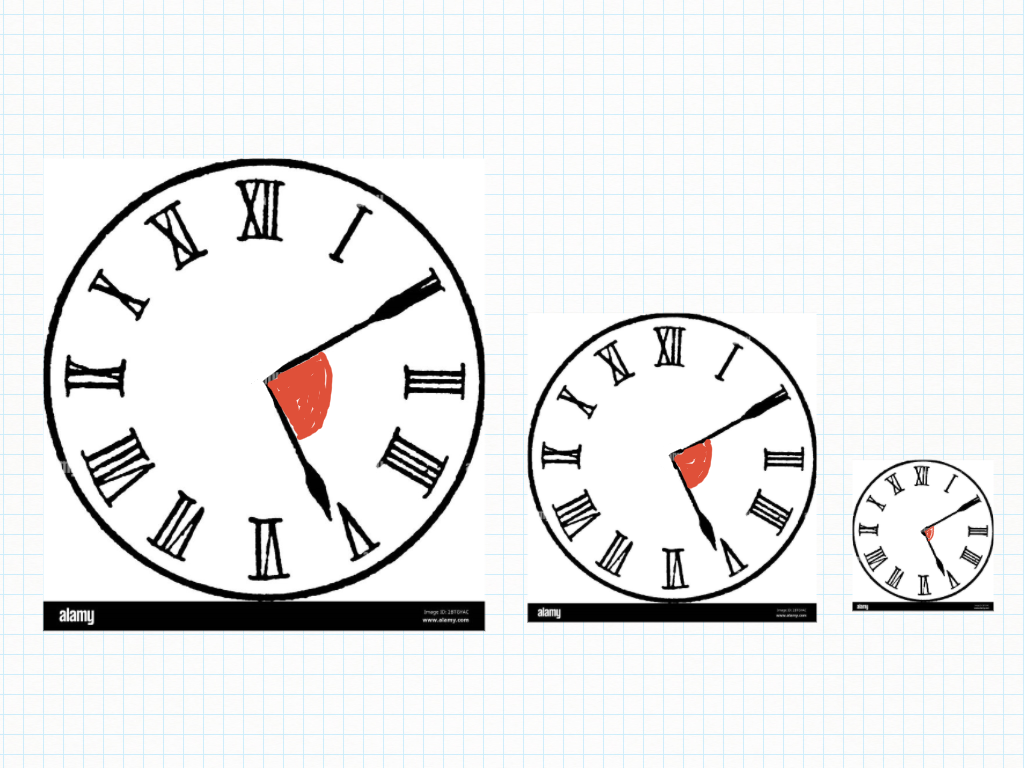
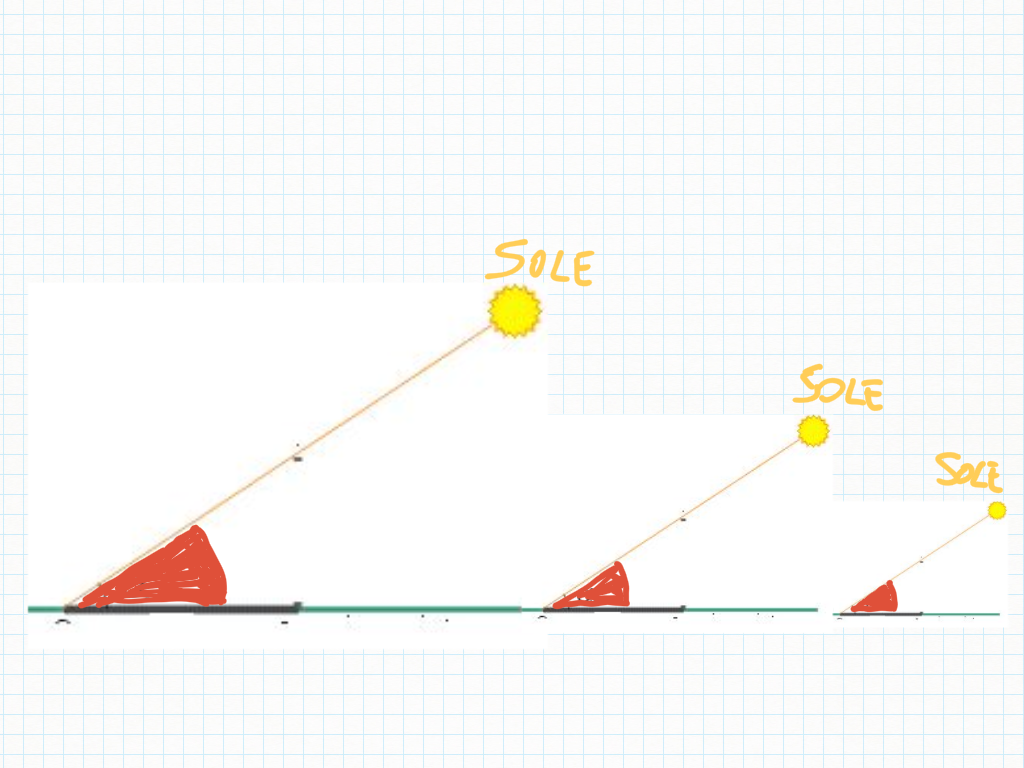
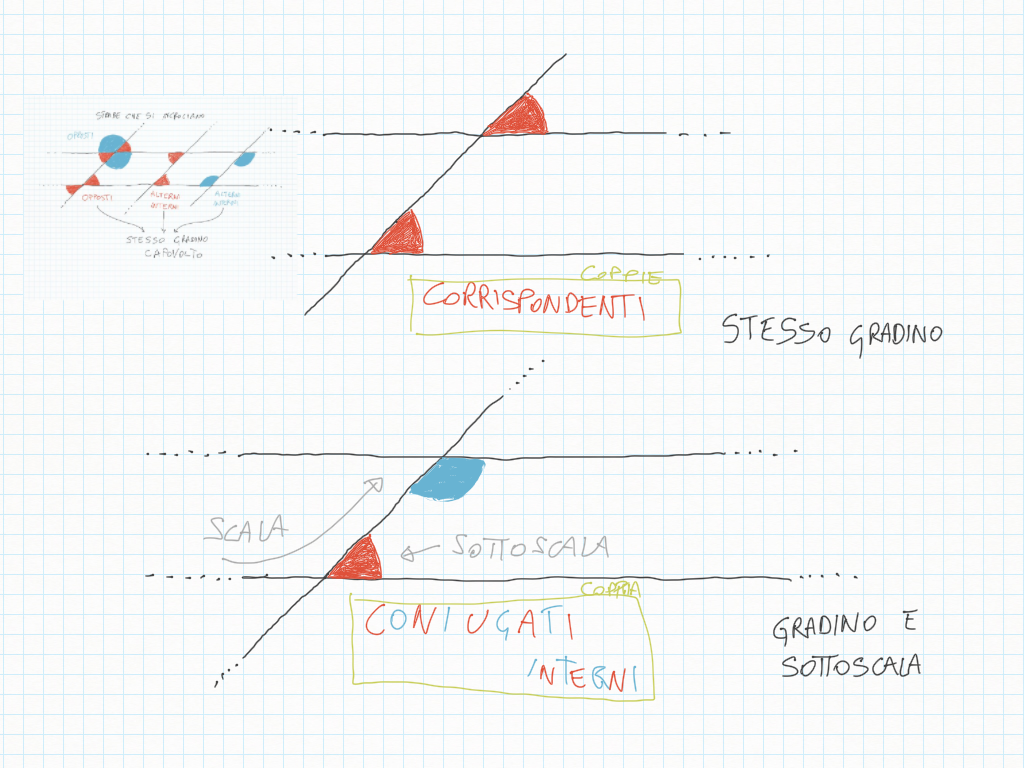
Un angolo è un'apertura di ventaglio, un orario (orologio/Sole), un'apertura di porta, di finestra: non una quantità di rosso.
Il ventaglio è un misuratore di ampiezze o forse, un “controllatore”: due ampiezze sono uguali? E' la stessa ora?
Hanno lo stesso gradino? Hanno lo stesso gradino, ma capovolto?
6 Maggio
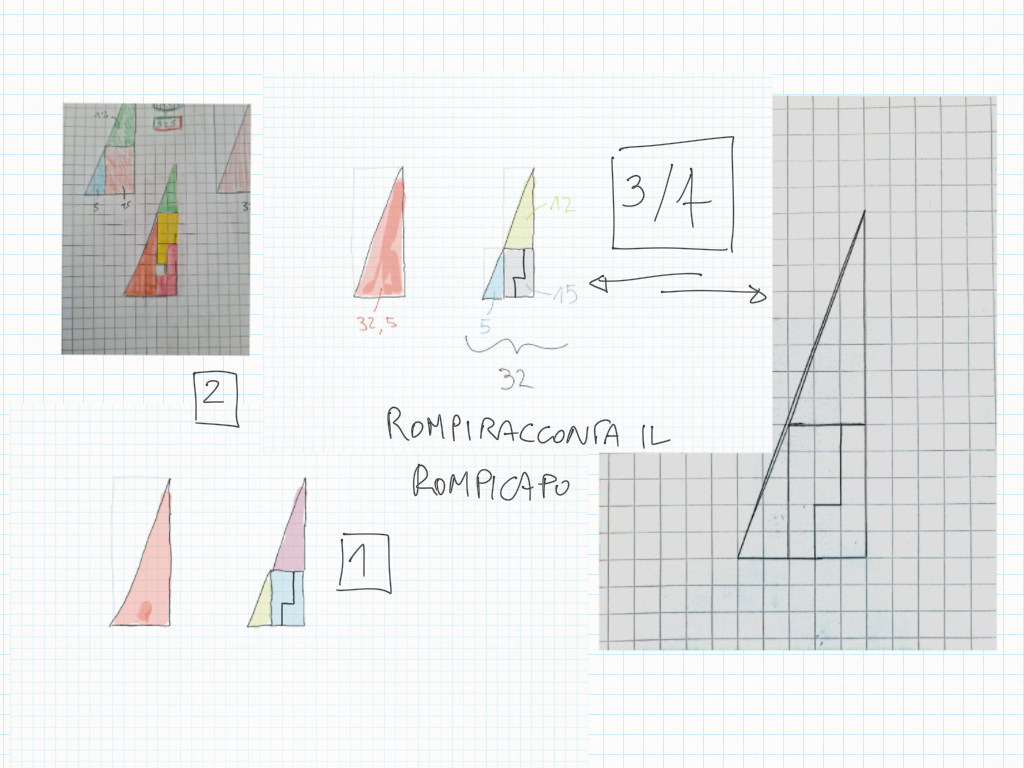
Rompiracconta il rompicapo
29 Aprile
22 Aprile
(pagina con immagini: https://telegra.ph/1C---22-Aprile-04-23)
Scienze




19 Aprile
Scienze
Processi stocastici
Qui: Processi stocastici
18 Aprile
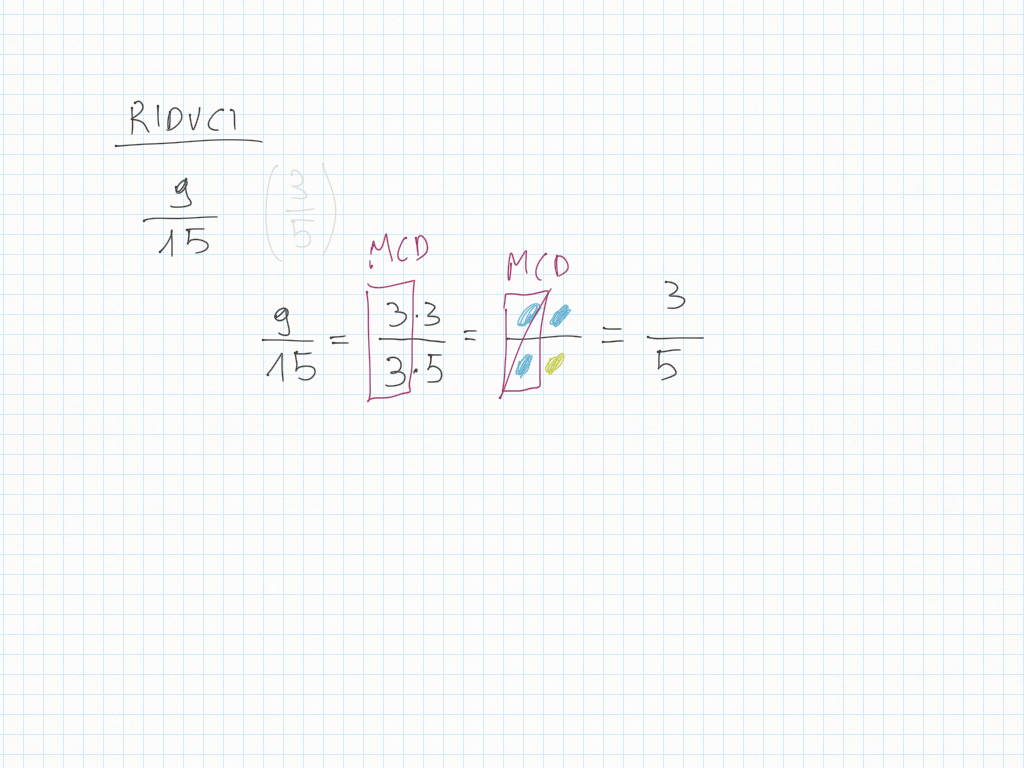
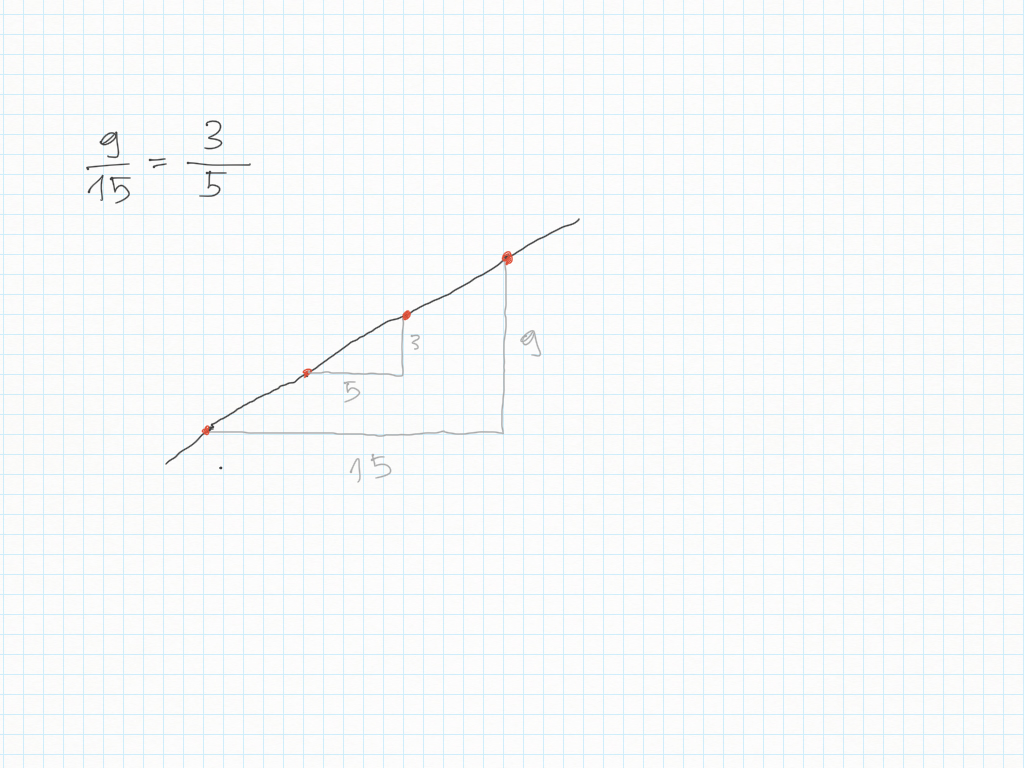
15 Aprile
12 Aprile
Il mondo microscopico: cose vive e cose non vive.
Il mondo microscopico funziona in modo stocastico (è basato su processi casuali di un enorme numero di “oggetti”/eventi: molecole e i loro movimenti casuali reciproci).
6 Aprile
Lavoro in classe, MCD e mcm
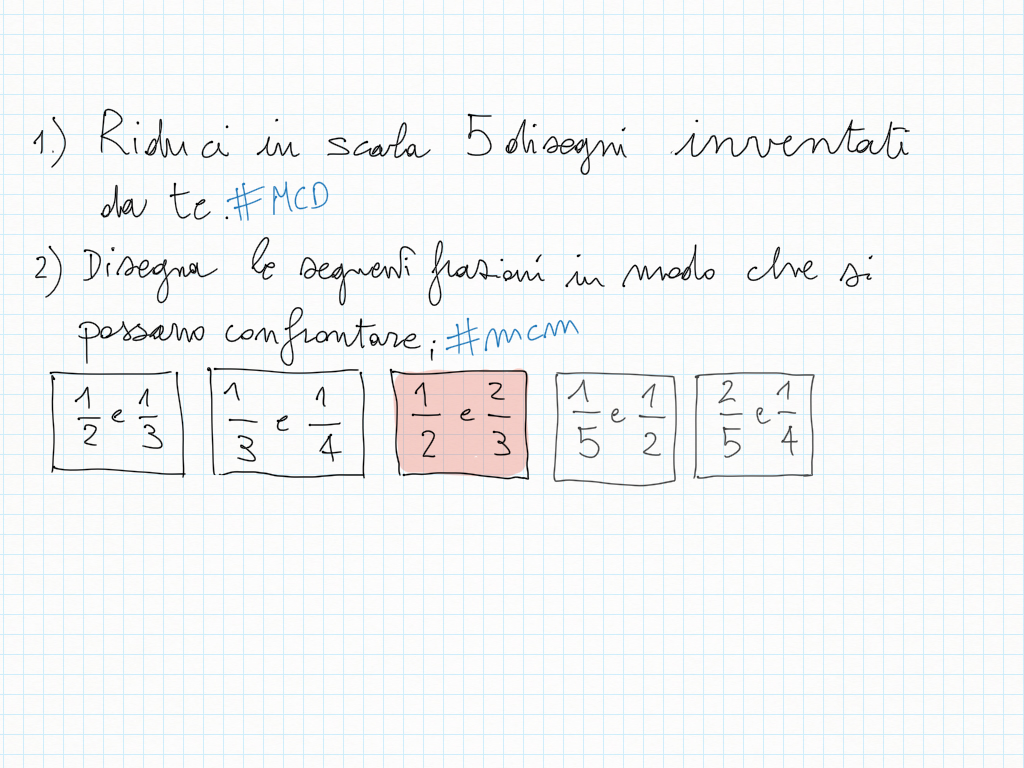

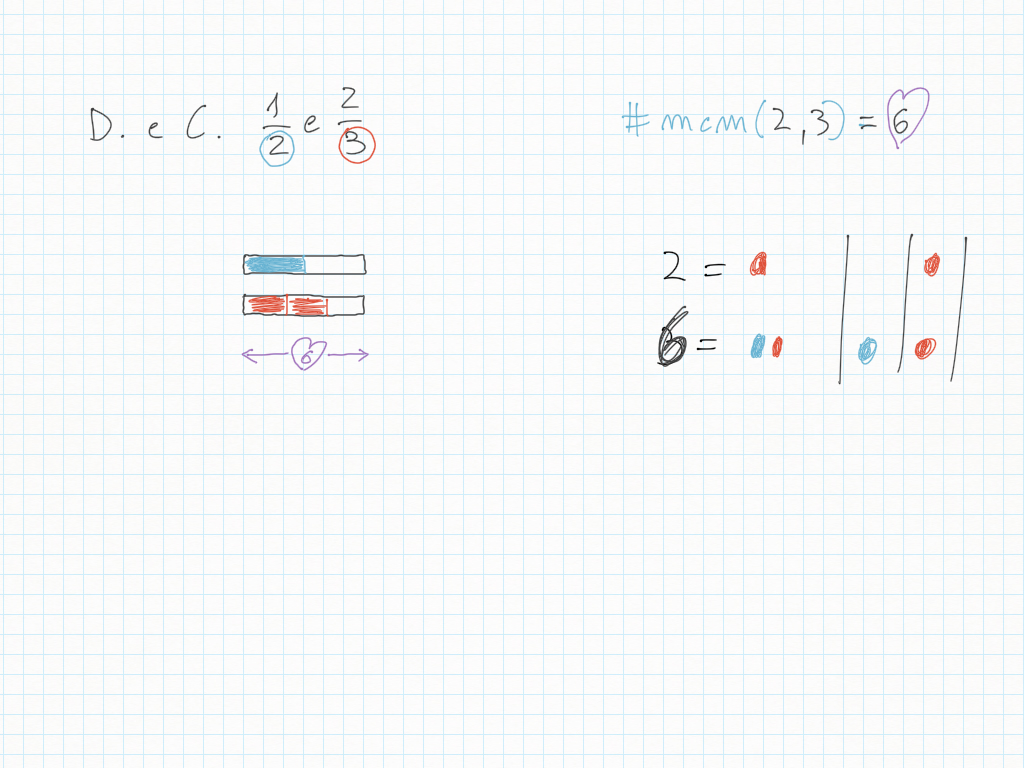
5 Aprile
Finora avevate lavorato voi, ora cerco di fare la mia parte.
Nell'elenco che segue il grassetto può servirvi per scegliere un punto di partenza.
Struttura
- nucleo:
- dimensioni;
- particelle (neutroni, protoni);
- protoni/numero atomico/tavola periodica;
- orbitali (costruisci un atomo):
- elettroni;
- regola dell'ottetto/orbitale più esterno;
- possibilità di condividere elettroni/legame chimico;
- Tavola di Lewis (ancora legami chimici);
- nucleo:
Origine greca del termine atomo: perché ne abbiamo parlato?
La molecola dell'acqua:
- legame tra gli atomi e polarità della molecola: gli elettroni condivisi sono attratti più dall'ossigeno che dall'idrogeno;
- polarità e struttura esagonale del reticolo dei legami idrogeno;
- ciclo termico dei laghi;
25 Marzo
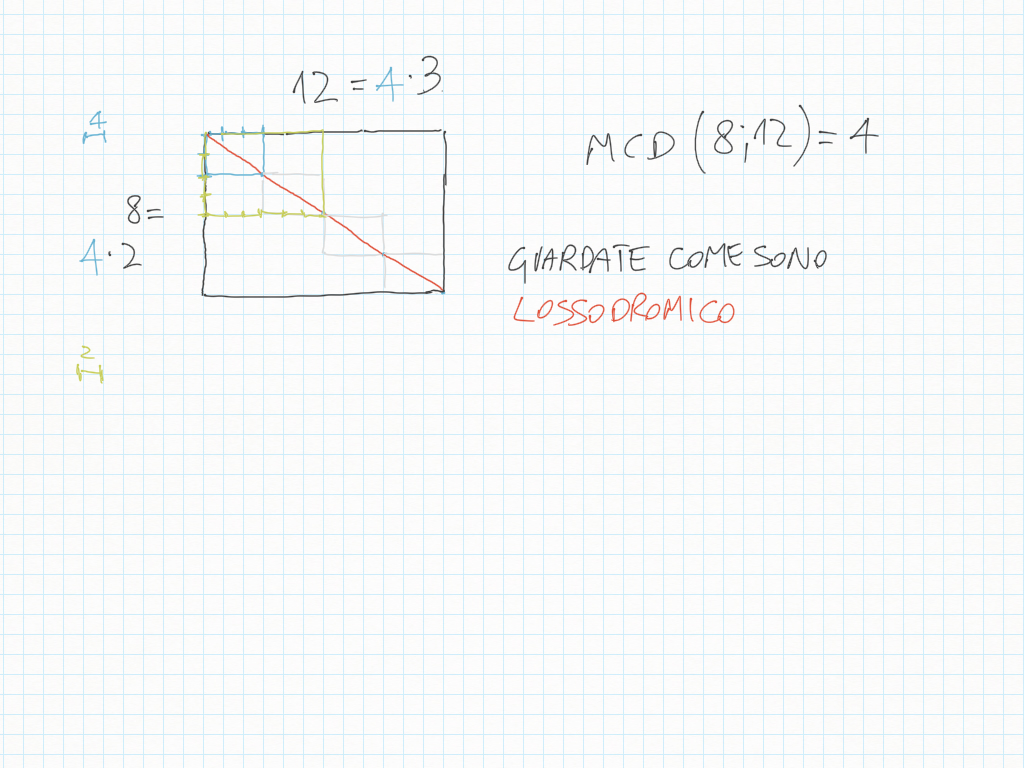
MCD, riduzioni in scala, lossodromia.
Lossodromia significa che gli angoli rimangono uguali quando si riduce o si ingrandisce. Ovviamente il profe fa apposta per insegnarci una parola che in pochi conoscono.
(loksodrómos è ‘che corre obliquamente’)
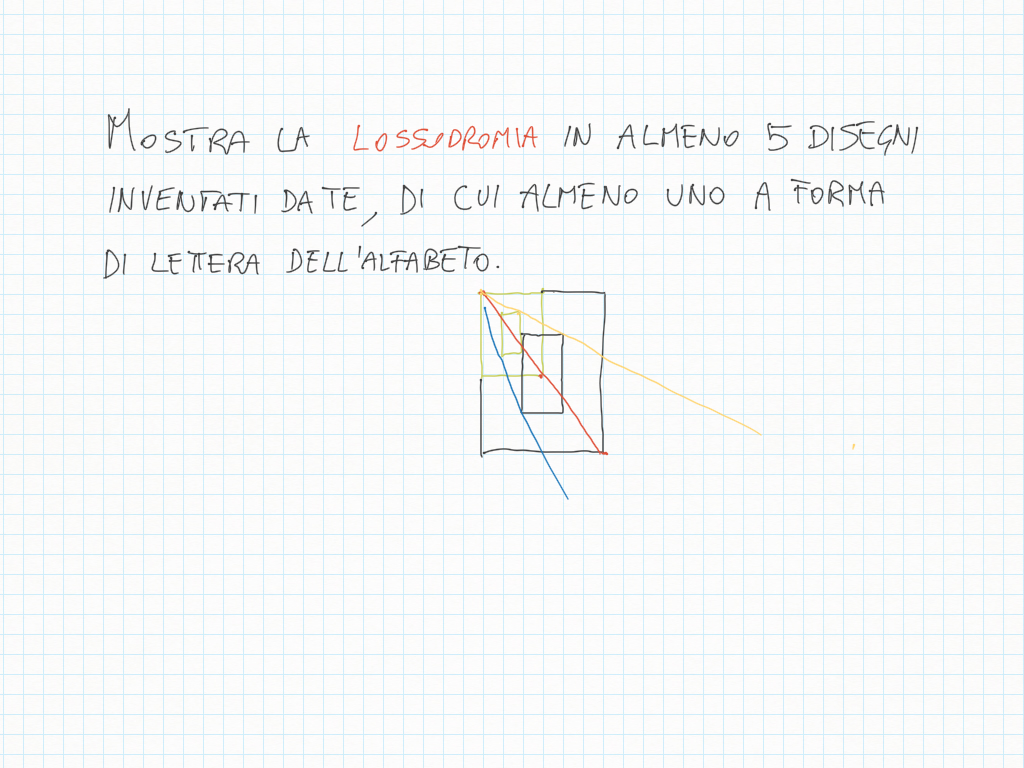
18 Marzo
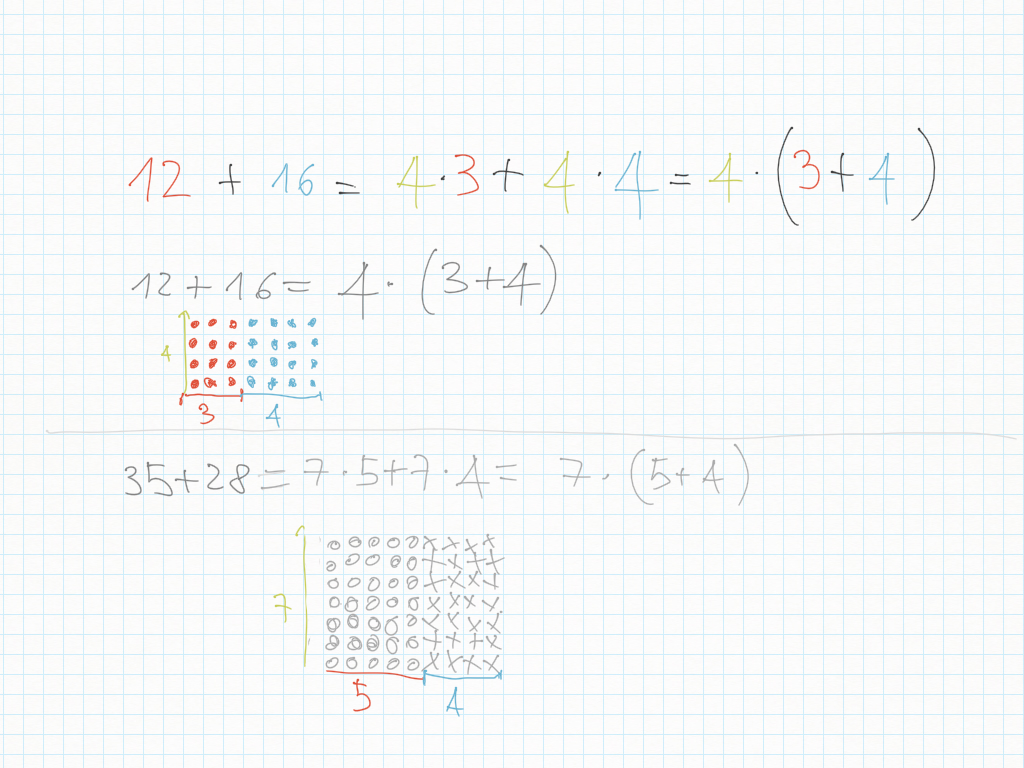
14 Marzo

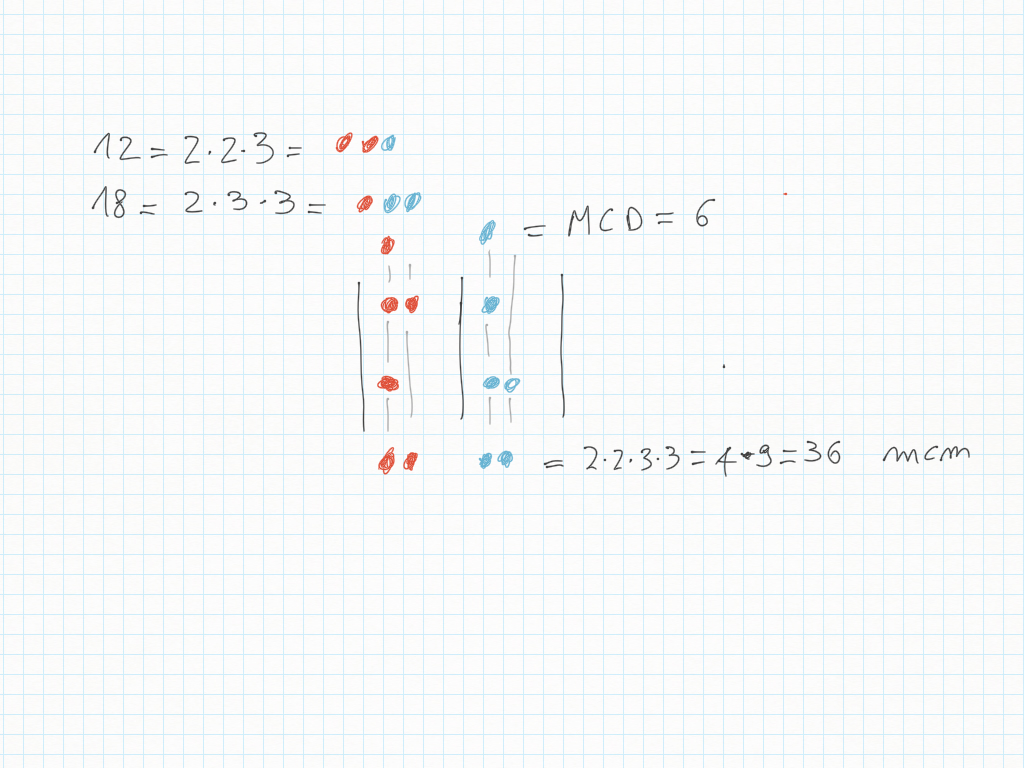
11 Marzo
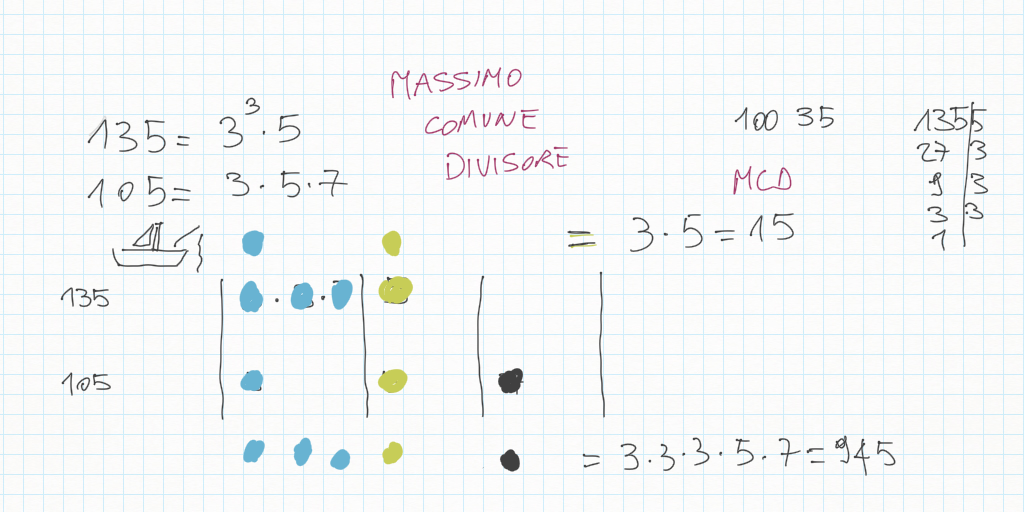
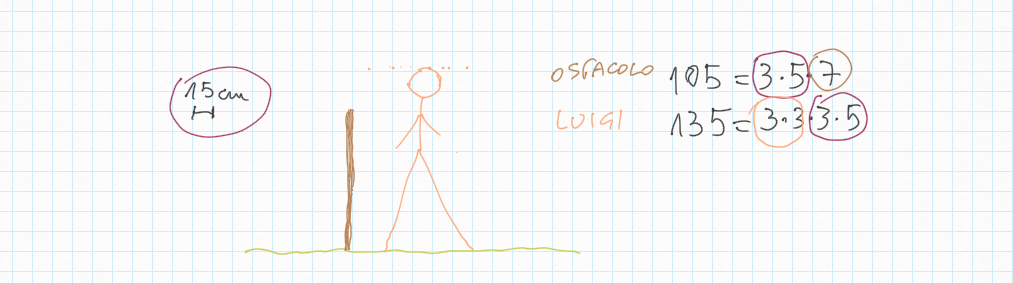
7 Marzo
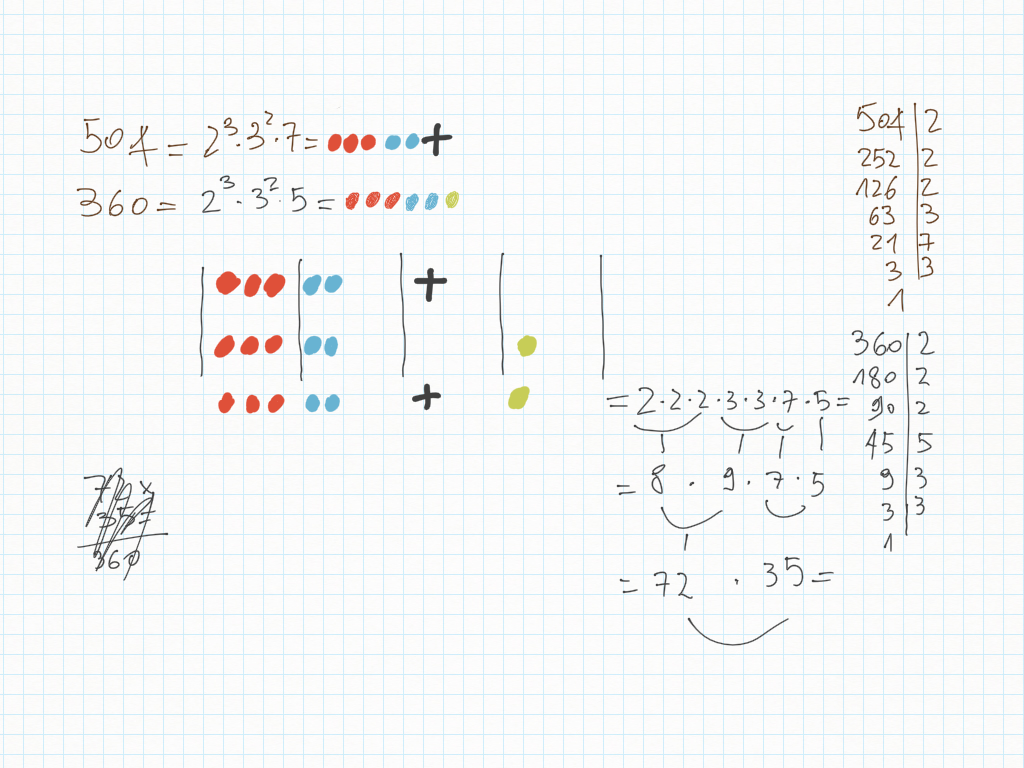
5 Marzo
Il ciclo termico dei laghi

Fine primavera, ad un certo punto tutta l'acqua si trova alla temperatura di 4 gradi.
Andando verso l'estate l'acqua si riscalda a partire dall'alto.
Questo riscaldamento prosegue fino a riguardare tutta l'acqua (figura 4).
Dopo l'estate, l'acqua comincia a raffreddarsi, diventando più densa. Essendo più densa sprofonda, facendo sollevare quella sottostante.
Si raffredda quella sopra...
Si rimescola...
Ne è rimasta un poco di calda in alto...
Ad un certo punto sarà tutta a 4°C nuovamente.
Comincia il freddo: gli strati superiori si raffreddano, ma TAAAAAAAAC, non sprofondano perché più freddi di 4°C.
L'acqua sul fondo, a 4°C, non subirà rimescolamenti e rimarrà tutto l'inverno “a scaldare i pesciolini”.
I corpi d'acqua (laghi, pocie, mari) ghiacciano dall'alto a causa dei legami idrogeno.
4 Marzo
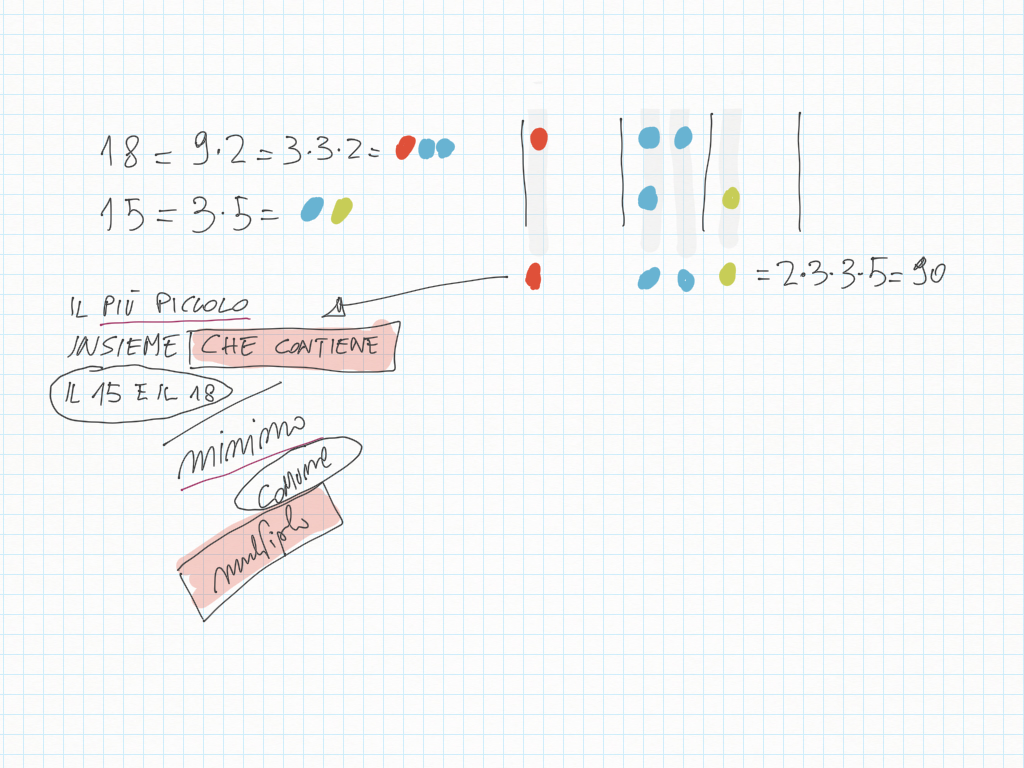
29 Febbraio
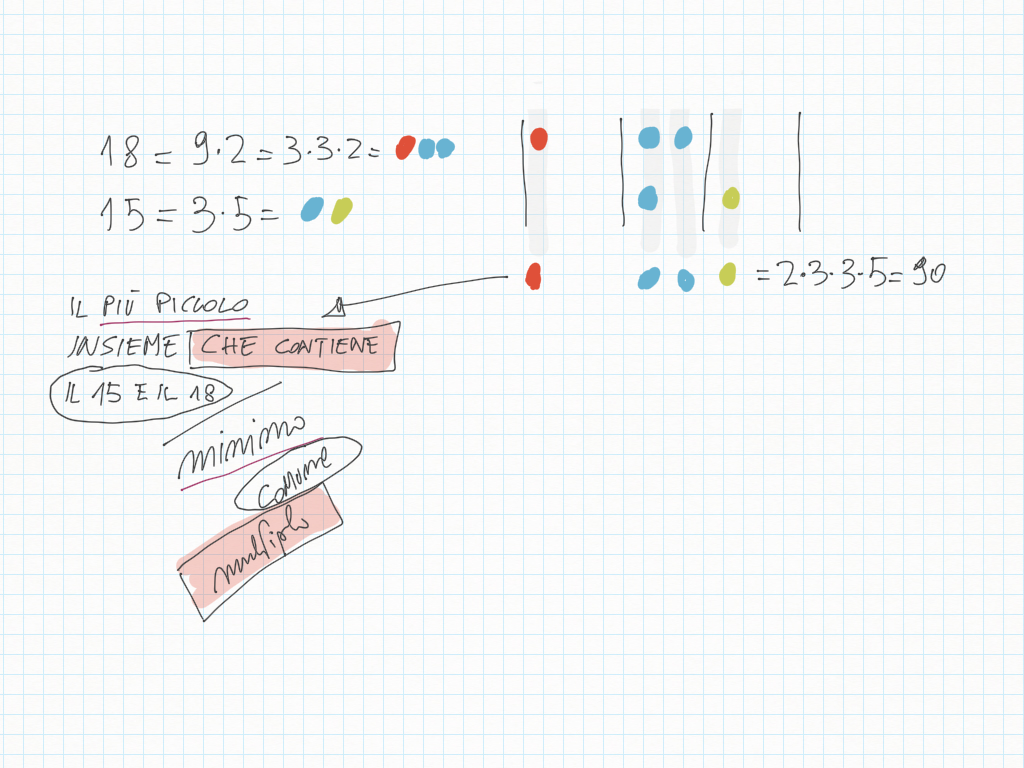
Due rane saltano l'una 4 quadretti, l'altra 3 quadretti. Evidenzia i punti lungo la strada in cui entrambe toccano lo stesso punto.

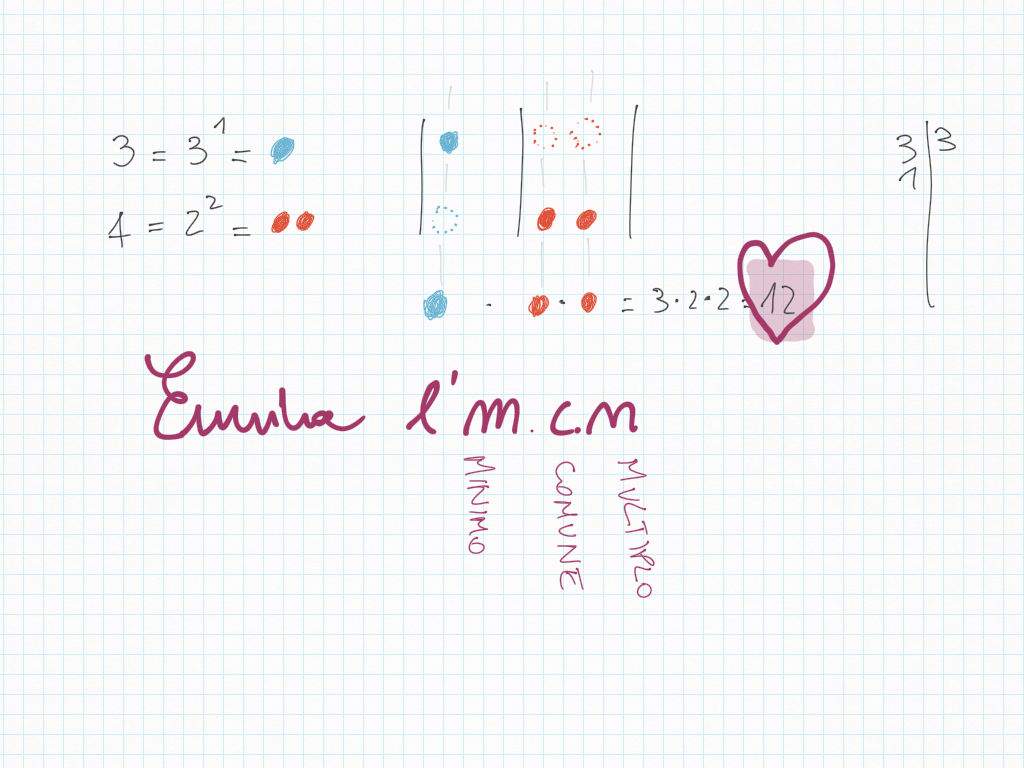
Abbiamo trovato il multiplo comune più piccolo, detto minimo comune multiplo, detto anche m.c.m..
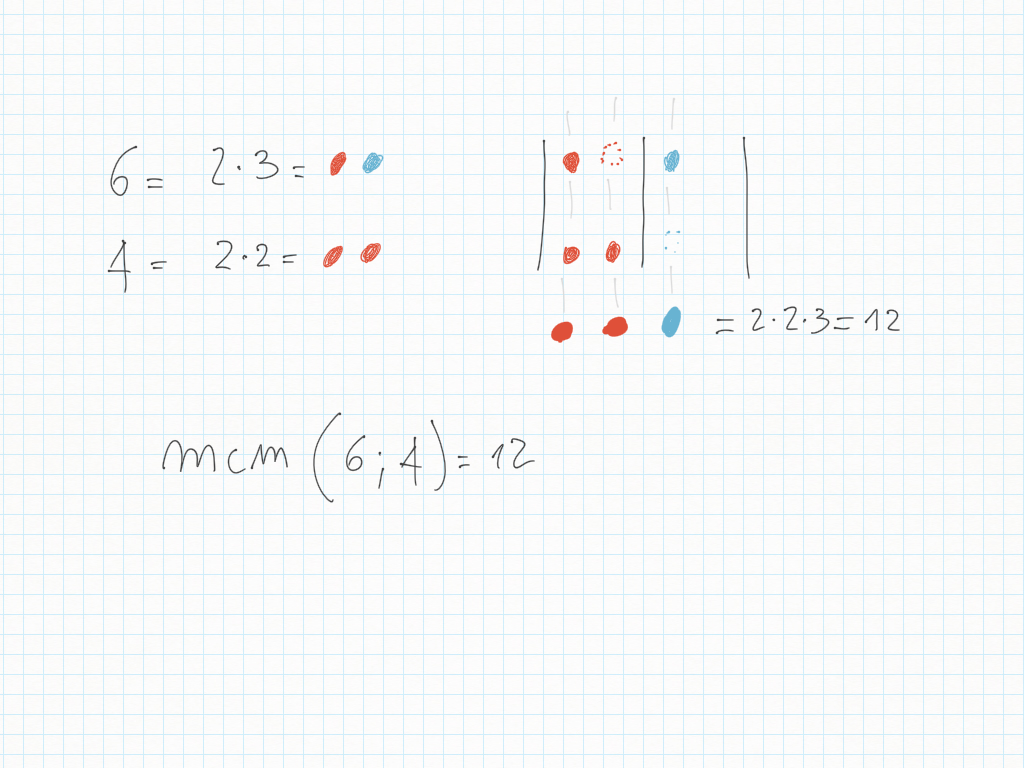
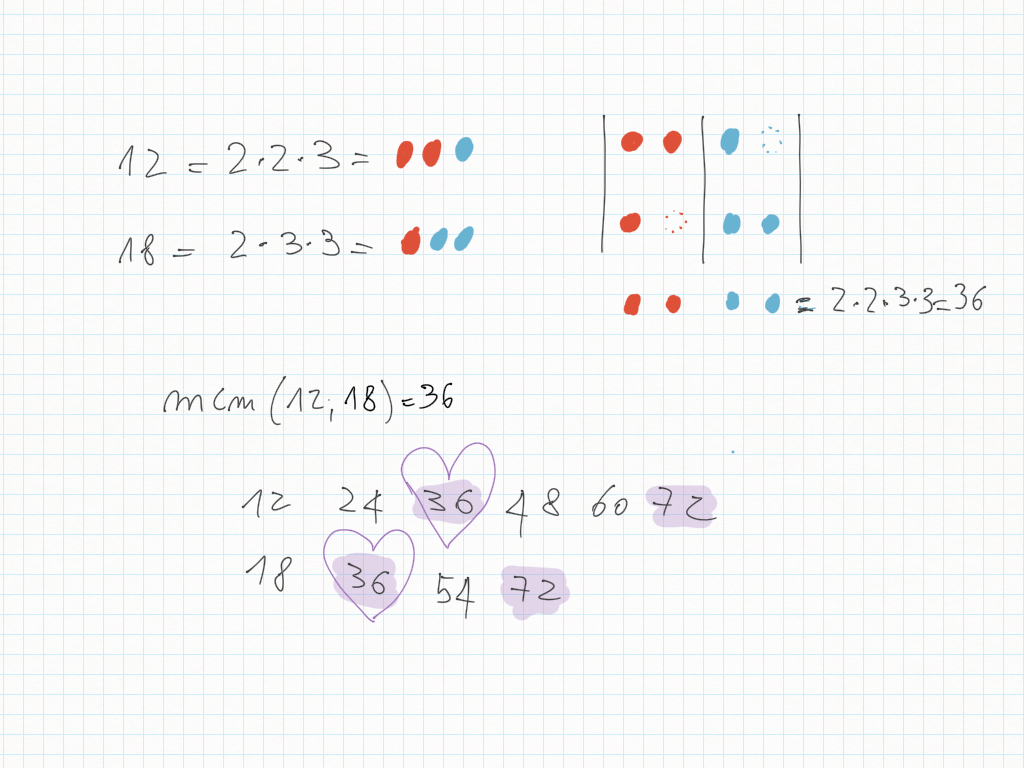
20 Febbraio
La densità dell'acqua
compito per venerdì: questo video: https://www.youtube.com/watch?v=UukRgqzk-KE
togliete l'audio, rallentate il video, e impostate i sottotitoli
anche su yewtu.be: https://yewtu.be/watch?v=UukRgqzk-KE
Per osservare il comportamento delle molecole dell'acqua abbiamo/ho utilizzato questa simulazione: https://phet.colorado.edu/sims/html/states-of-matter/latest/states-of-matter_all.html
Poi abbiamo disegnato questa figura:

19 Febbraio

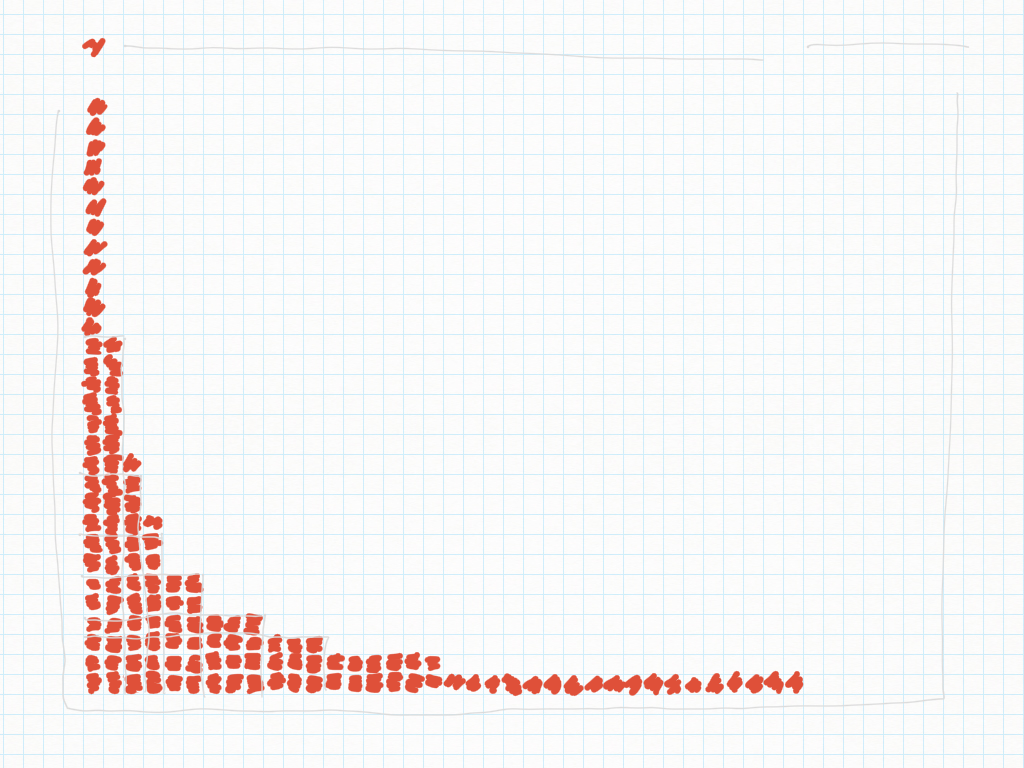
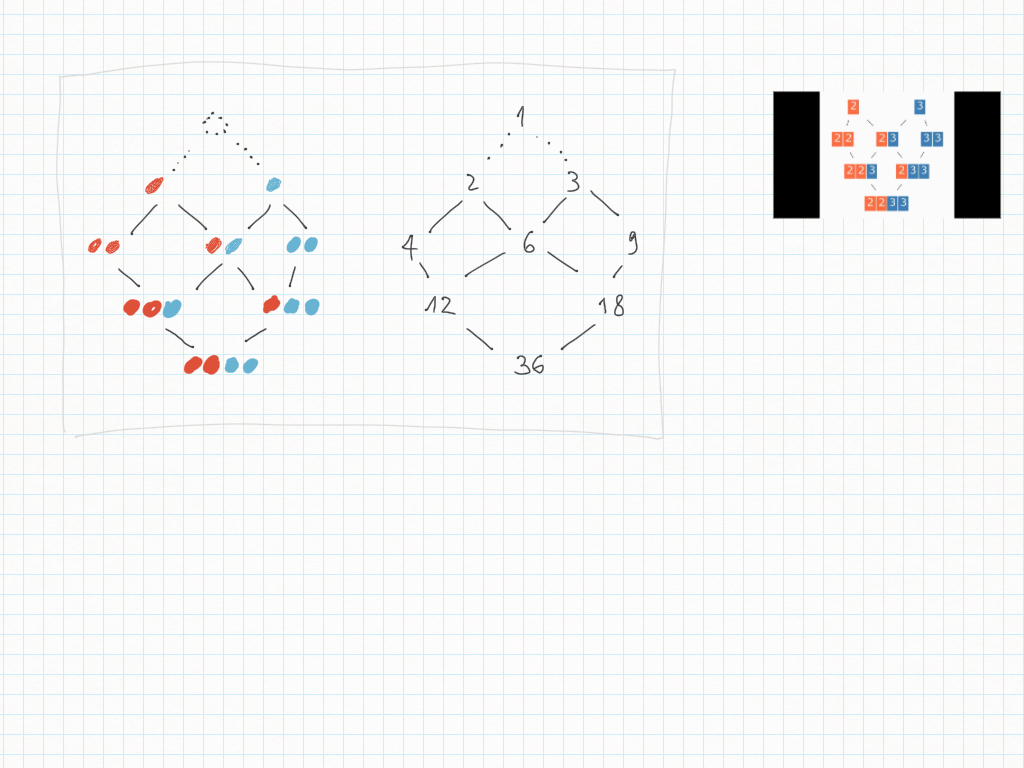

16 Febbraio
Il 36 e le (7?) fatiche di ALUNNERCOLE

9 Febbraio
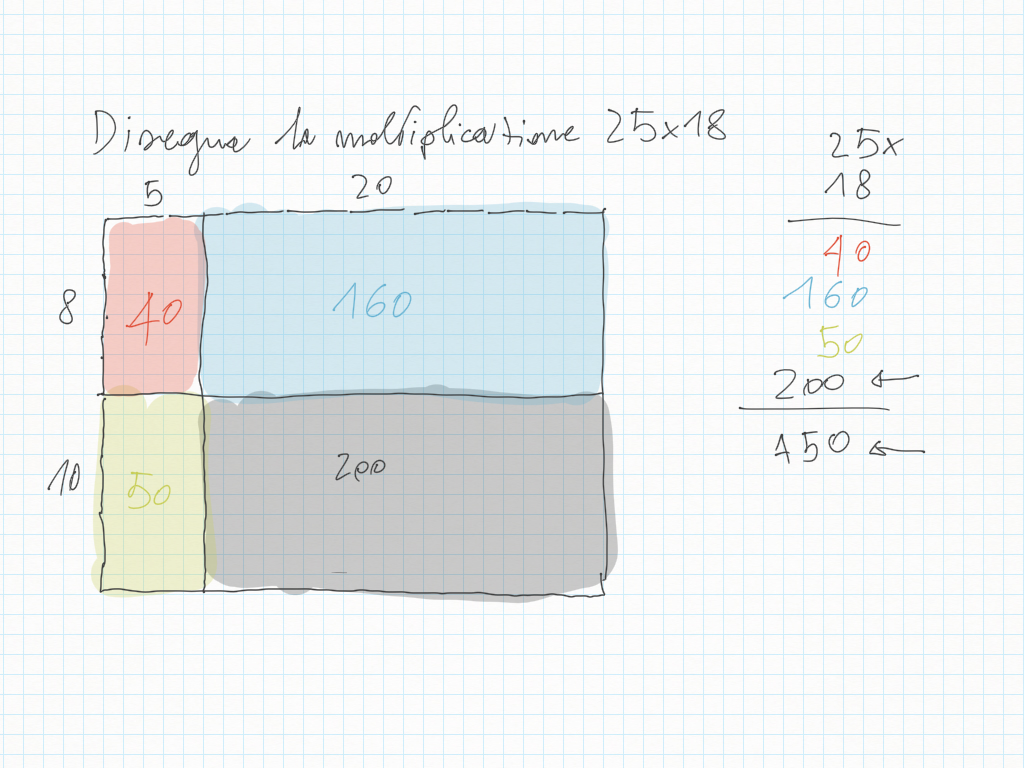
8 Febbraio
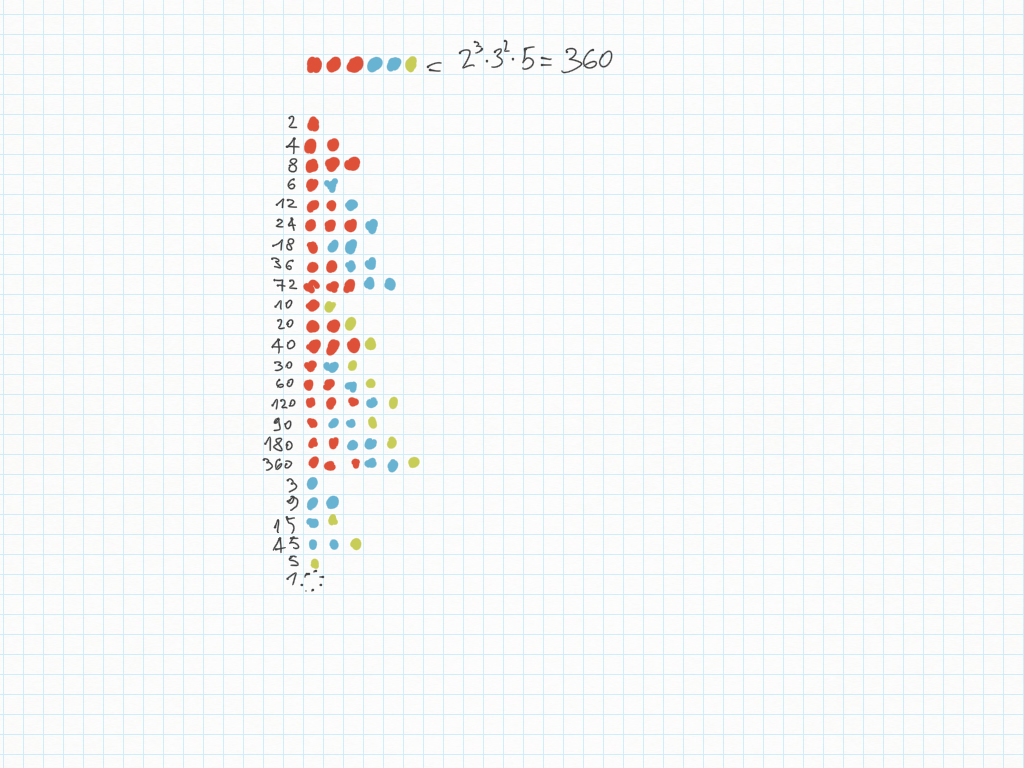


6 Febbraio

5 Febbraio
Scienze
La densità dell'acqua
Normalmente un liquido che si raffredda diventa sempre più denso e, quando solidifica, affonda, risultando/essendo più pesante del liquido in cui è immerso.
L'acqua non si comporta in questo modo.
Nella siviera, un pezzo di metallo solido affonderebbe, mentre nel bicchiere, l'acqua solida galleggia.
Quando raggiunge i 4°C (3,98) l'acqua raggiunge anche il suo massimo di densità.
Matematica
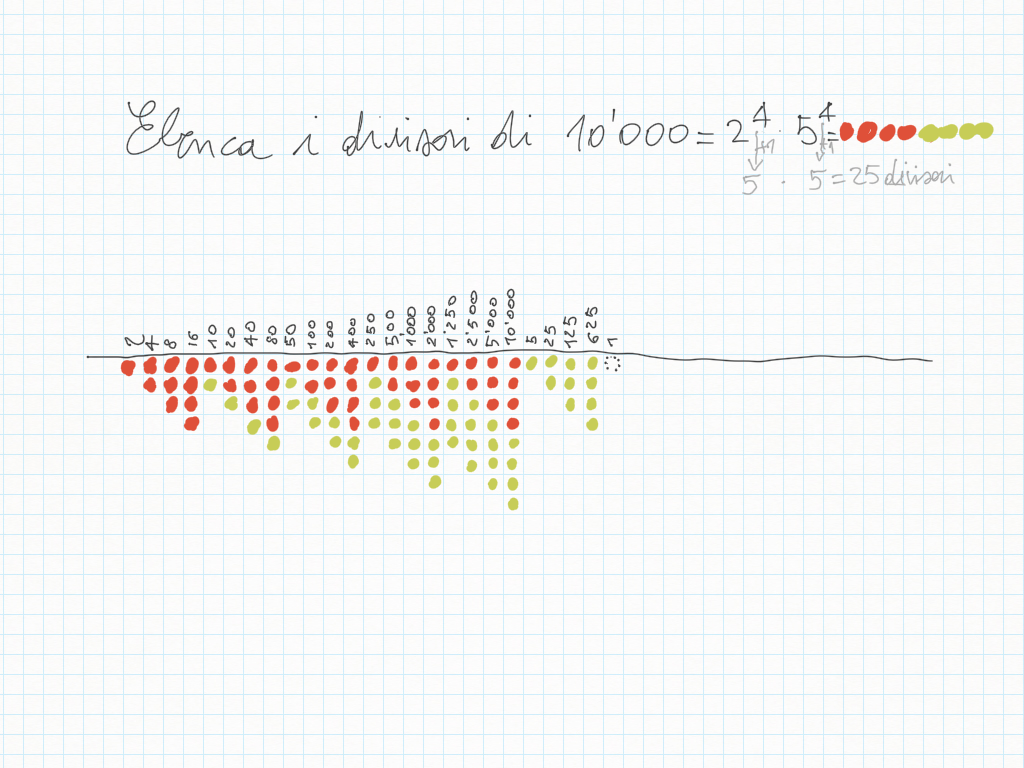
2 Febbraio
Scienze
Guardiamo insieme video – e riassunto – sulla polarità della molecola dell'acqua.
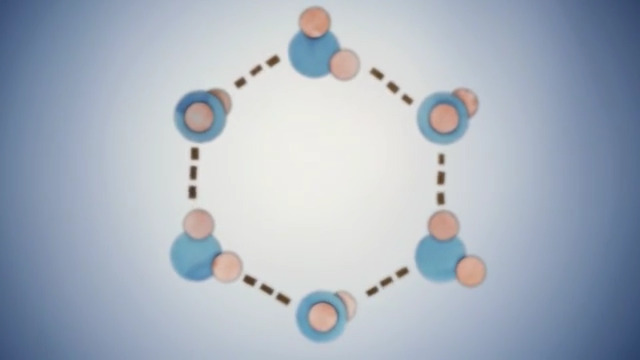


Matematica
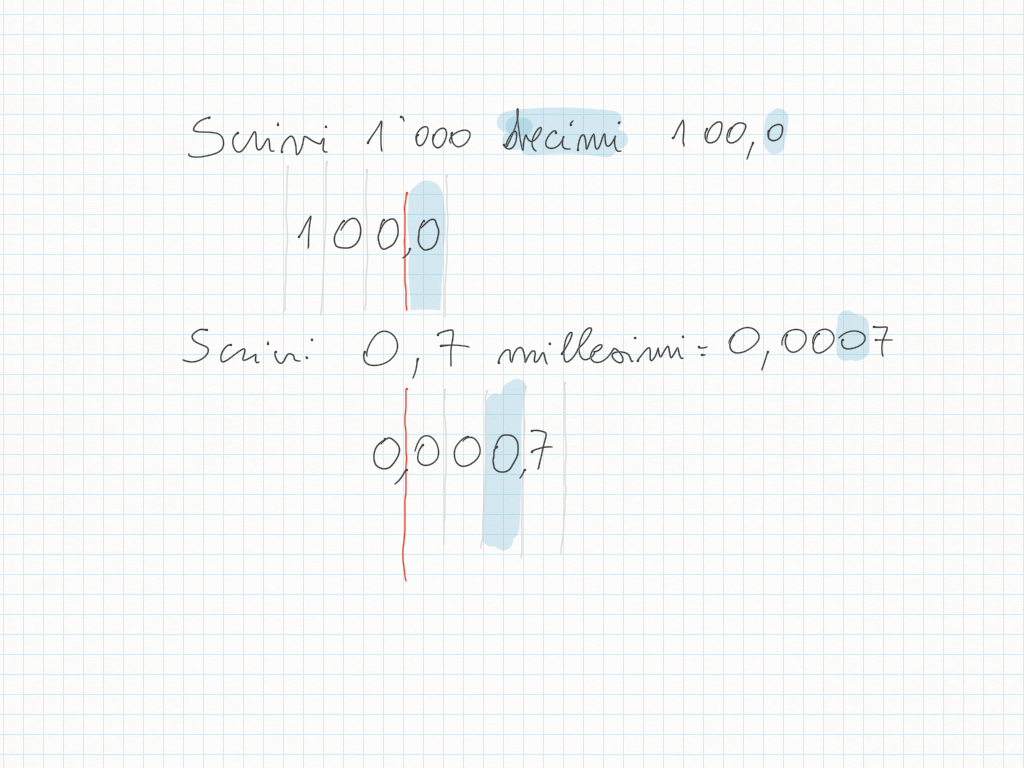
Compito per lunedì 5 Febbraio: sul quaderno i divisori di 1'000: trovate il filmato su yewtu.be, dove non c'è pubblicità o, se non “va”, direttamente su YouTube.
01 Febbraio
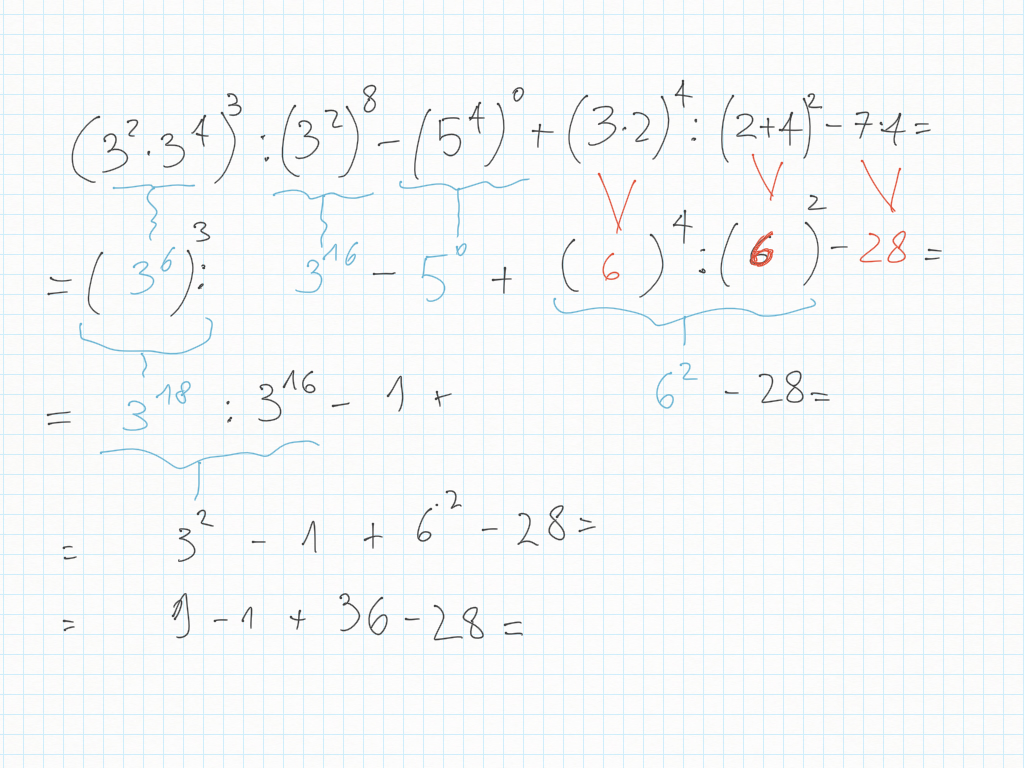
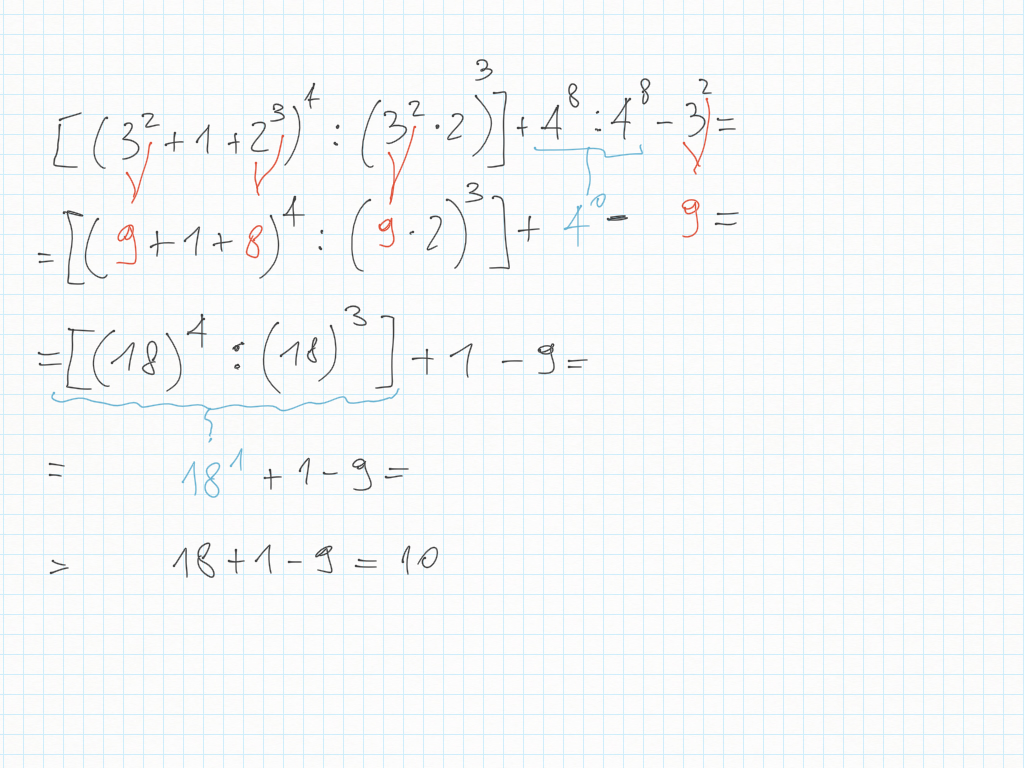


29 Gennaio
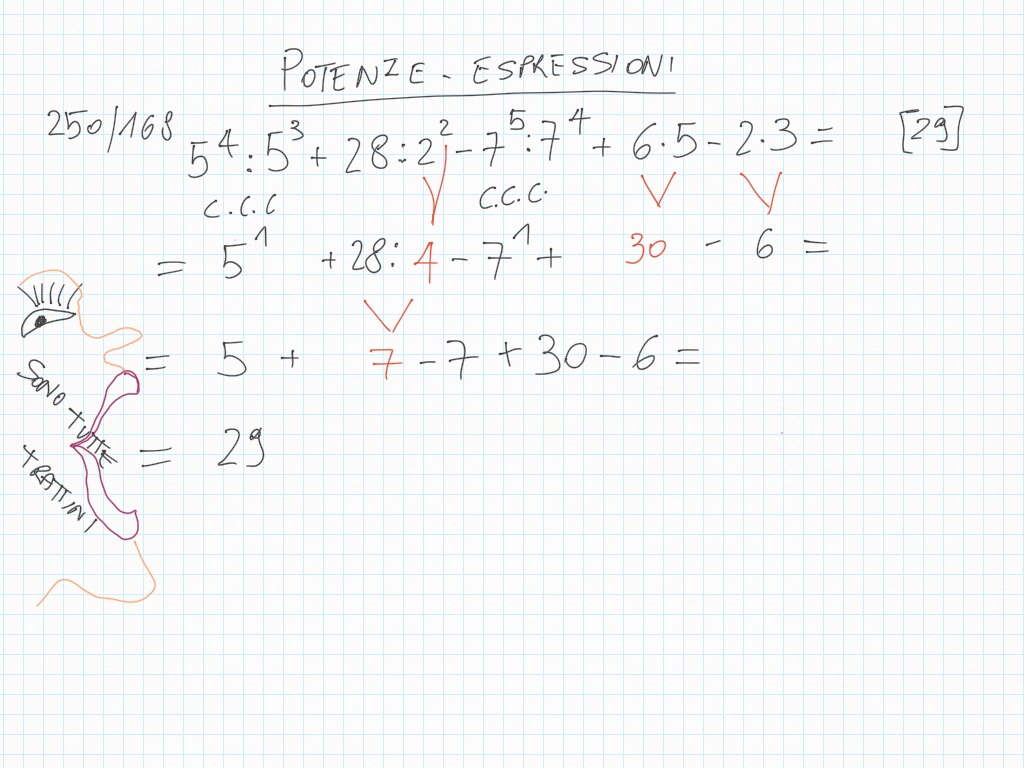
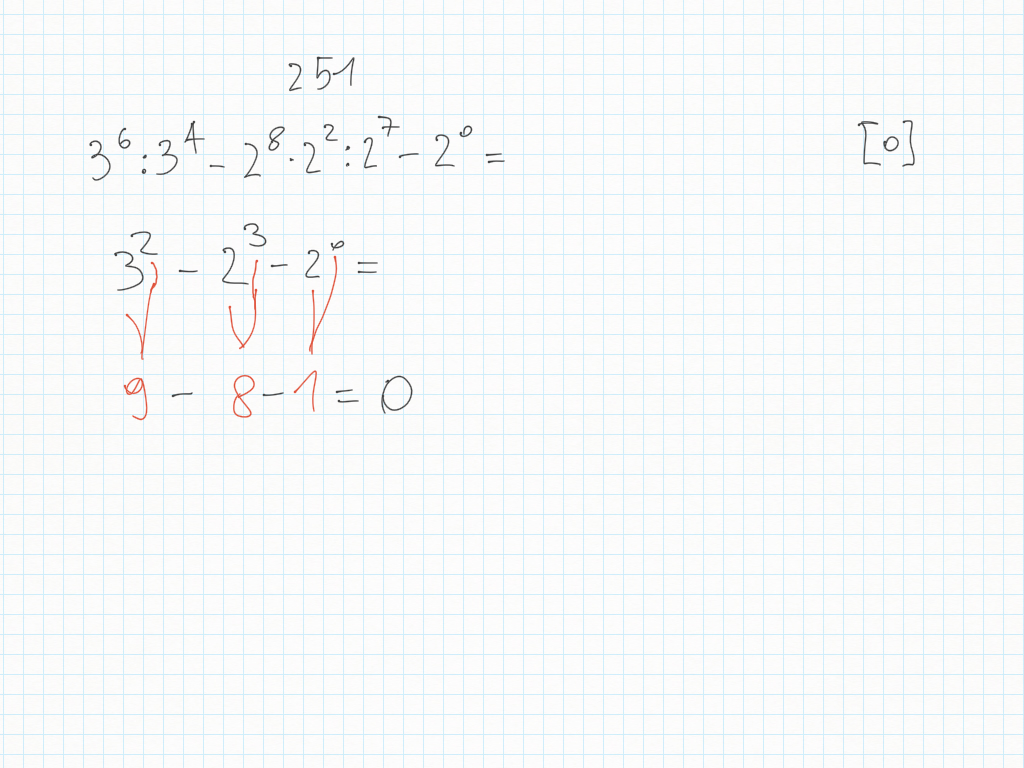

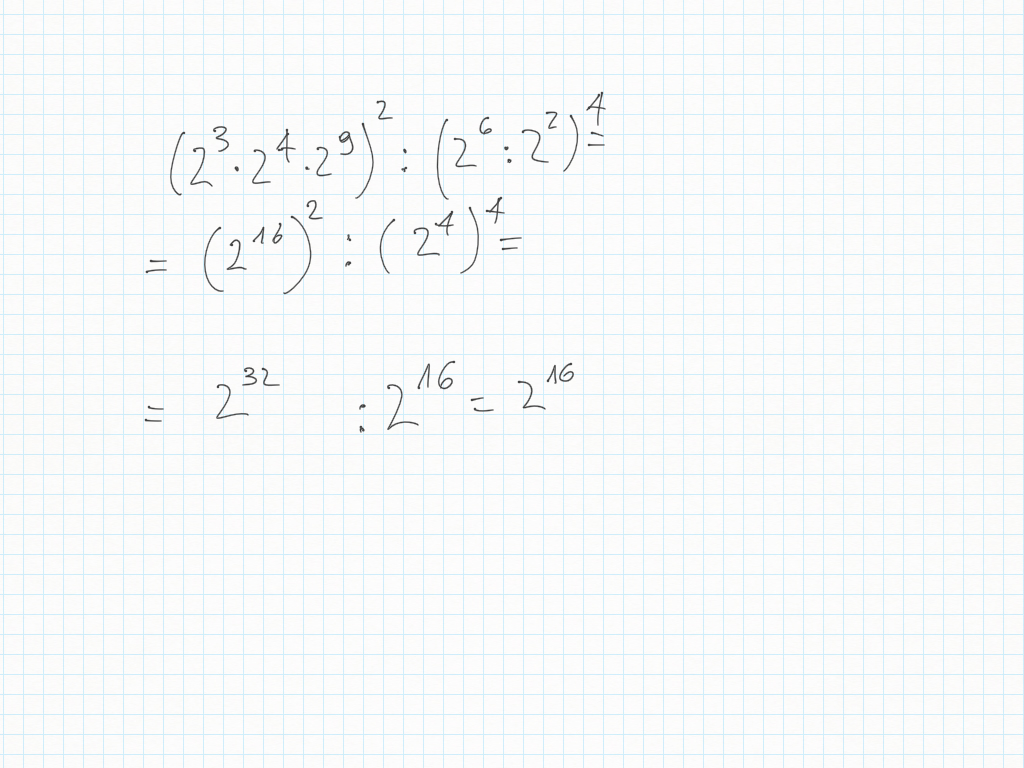

https://www.youtube.com/watch?v=AmFMJC45f1Q
26 Gennaio
Schema di riassunto del video sulla polarità della molecola dell'acqua: https://telegra.ph/Come-la-polarit%C3%A0-influisce-sul-comportamento-dellacqua-12-10
25 Gennaio
22 Gennaio




19 Gennaio
https://www.mauitaui.org/la-divisibilitagrave.html

Collegamento alla pagina per i compiti sulla divisione:
https://professosaurus.bearblog.dev/dividere-per-e-dividere-in/
18 Gennaio
Scienze
Schema di riassunto del video sulla molecola dell'acqua:
- l'atomo è vuoto (3:46);
- l'atomo è complessivamente neutro: le cariche positive dei protoni sono bilanciate... (4:20);
- gli elettroni orbitano a grande velocità (3:55);
- gli orbitali sono uno successivo all'altro; possono ospitare un certo numero di elettroni (4:50-5:10);
- schema bidimensionale della molecola dell'acqua (5:10-6:20);
- elettrone come nube e tridimensionalità della molecola/orbitali (fino a 7:51);
- la molecola nella sua interezza (8:00-9:00).
Matematica


16 Gennaio


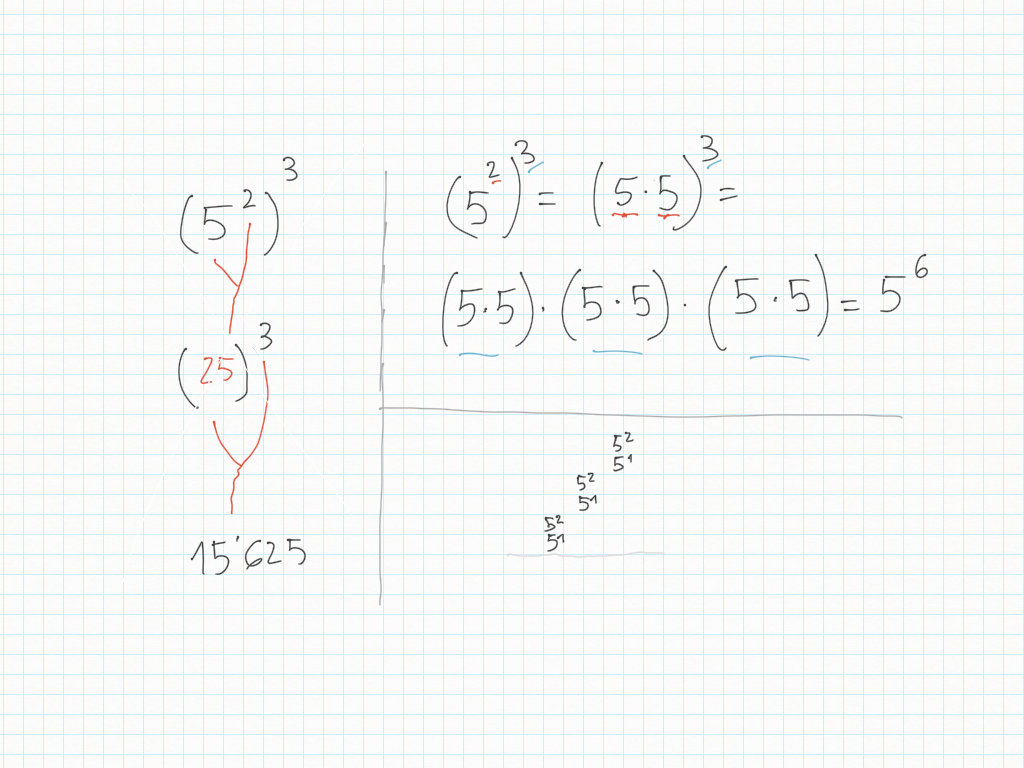
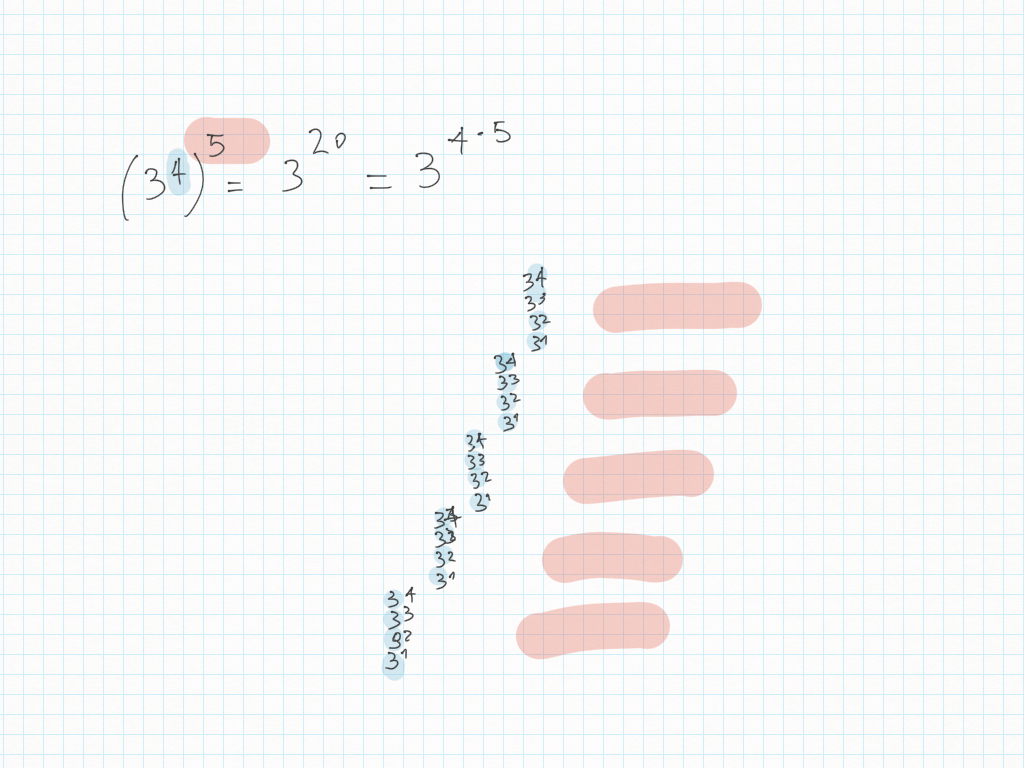

Esercizi di compito – Correzione

15 Gennaio
Matematica

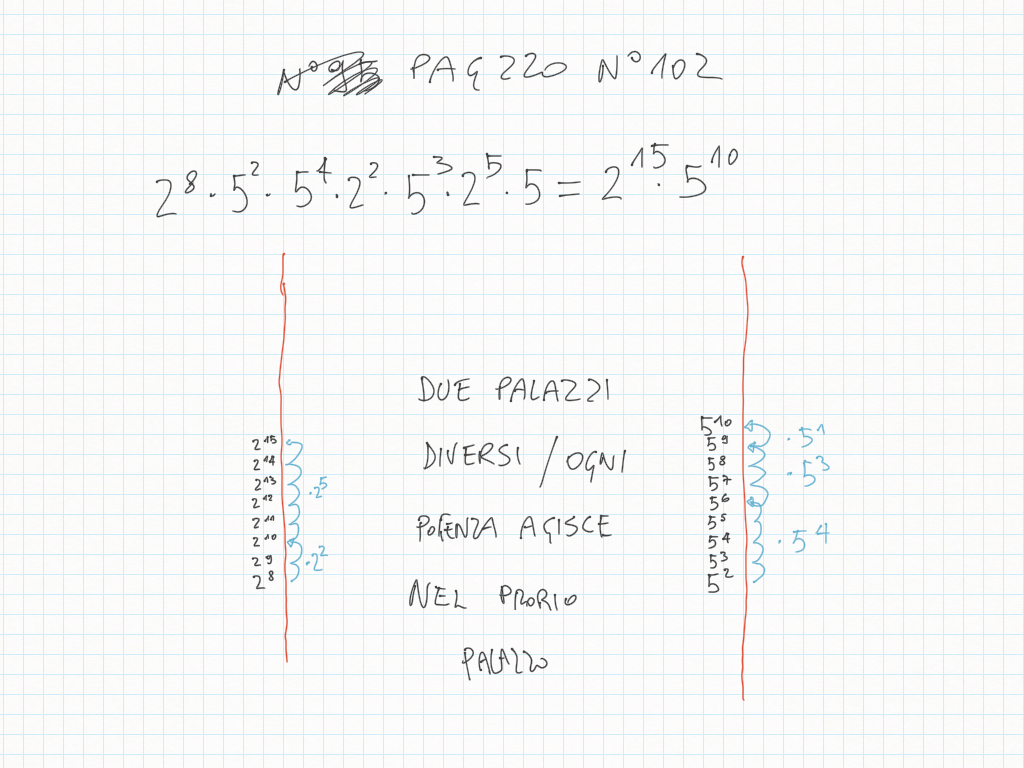
Scienze
Proseguiamo con un'altra caratteristica apparentemente contraddittoria degli atomi, quando si legano:

In effetti, quando gli elettroni vengono condivisi, non “se ne stanno” vicini, ma condividono uno stesso orbitale.


12 Gennaio

11 Gennaio
Matematica

Scienze
Alcune osservazioni sul comportamento delle cariche elettriche nell'atomo...
Nel nucleo sono presenti solo cariche positive... Perché non si respingono, allontanandosi e “disfacendo” il nucleo medesimo?
Bella domanda. Oltre alla forza elettrica, che respinge i protoni tra loro, esiste una forza, detta forza nucleare debole, che invece li tiene insieme.
In natura esistono infatti quattro forze/interazioni fondamentali:
- gravitazionale;
- elettromagnetica;
- nucleare debole;
- nucleare forte;
9 Gennaio


8 Gennaio
Scienze
Numeri dell'atomo
Usando Costruisci un atomo dobbiamo imparare a descrivere un atomo in quattro modi:
- numero atomico Z: numero di protoni;
- numero di massa A: numero di nucleoni (componenti del nucleo, protoni+neutroni); solo il nucleo ha massa;
- carica netta;
- è uno ione sì/no;
Matematica
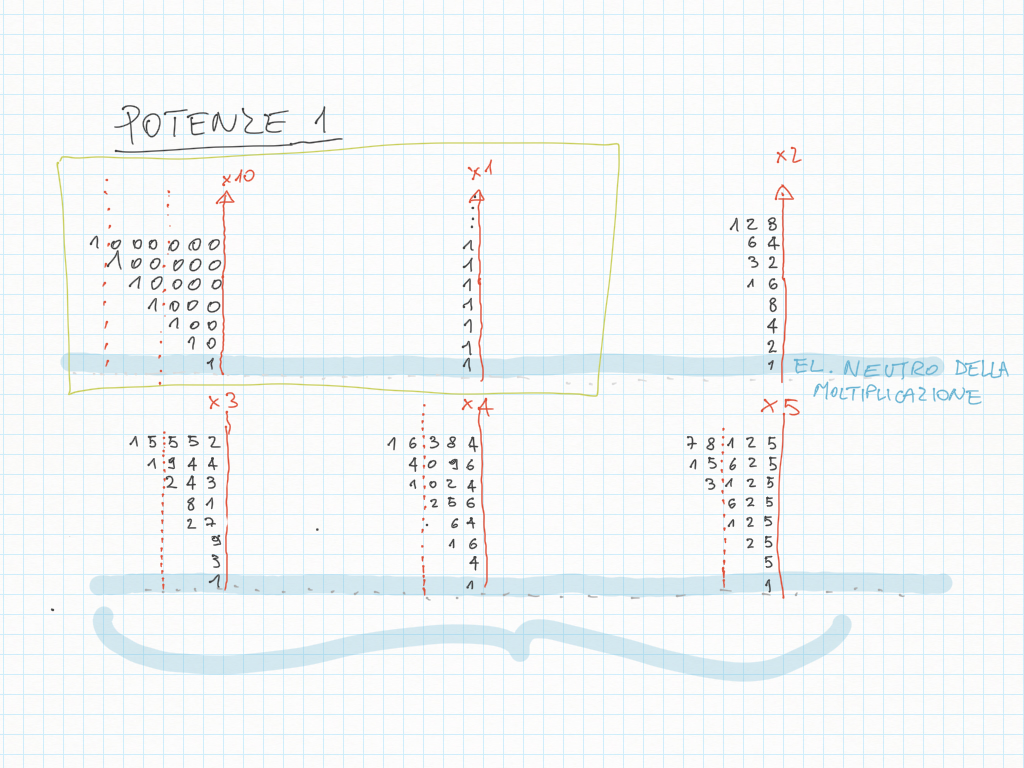
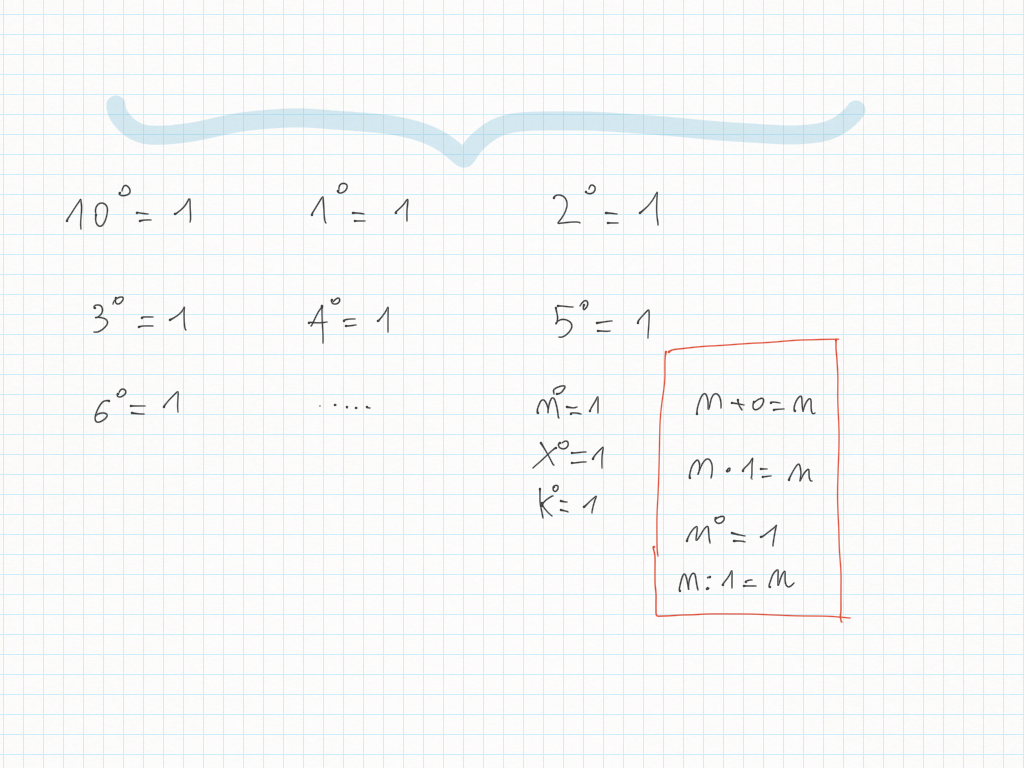

21 Dicembre



18 e 19 Dicembre
Trovate le lavagne qui: https://telegra.ph/1C---18-e-19-Dicembre-12-19
14 Dicembre

12 Dicembre
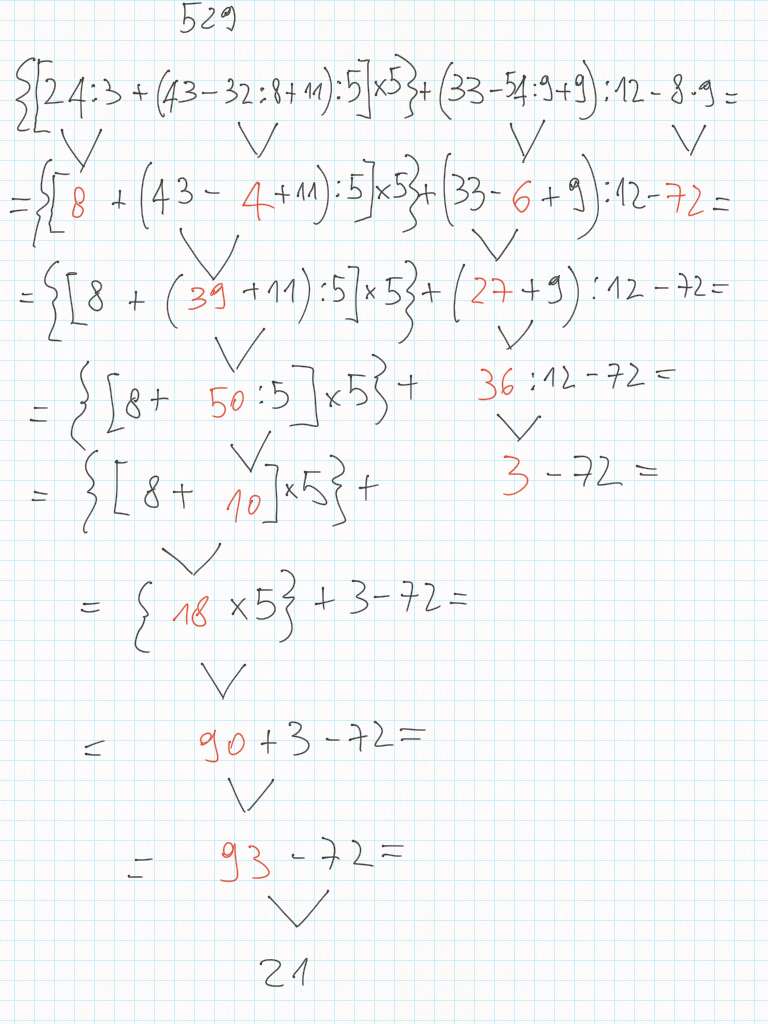
11 Dicembre
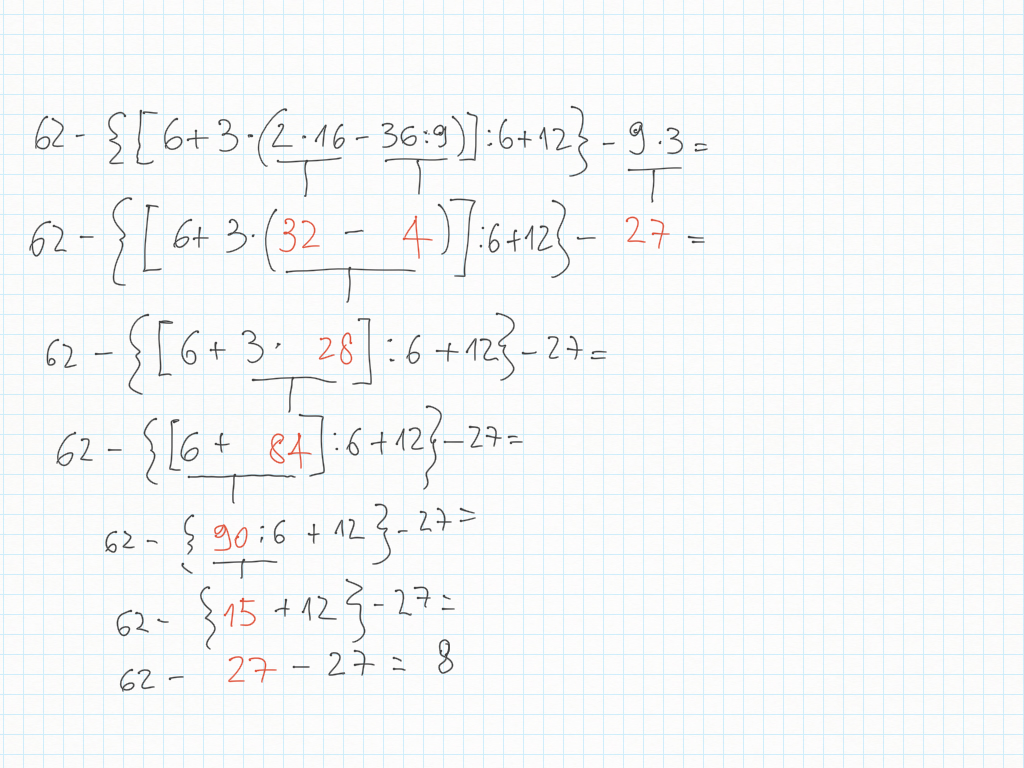
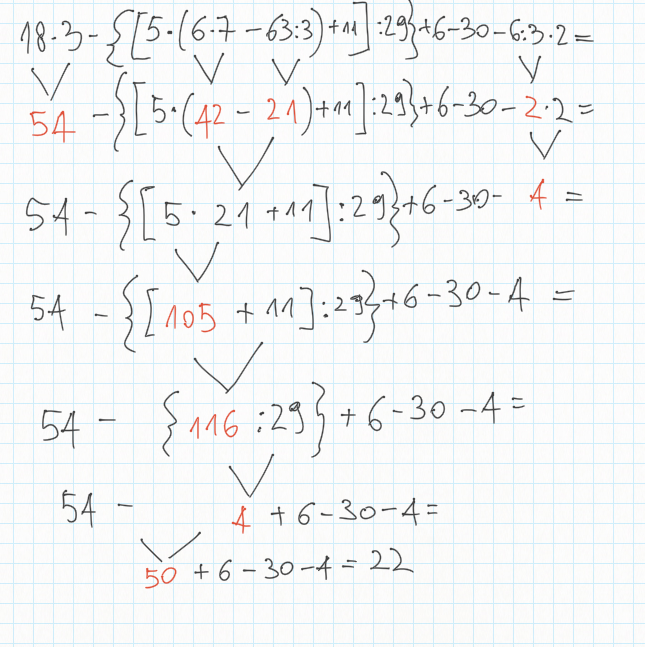

7 Dicembre
Matematica

Scienze


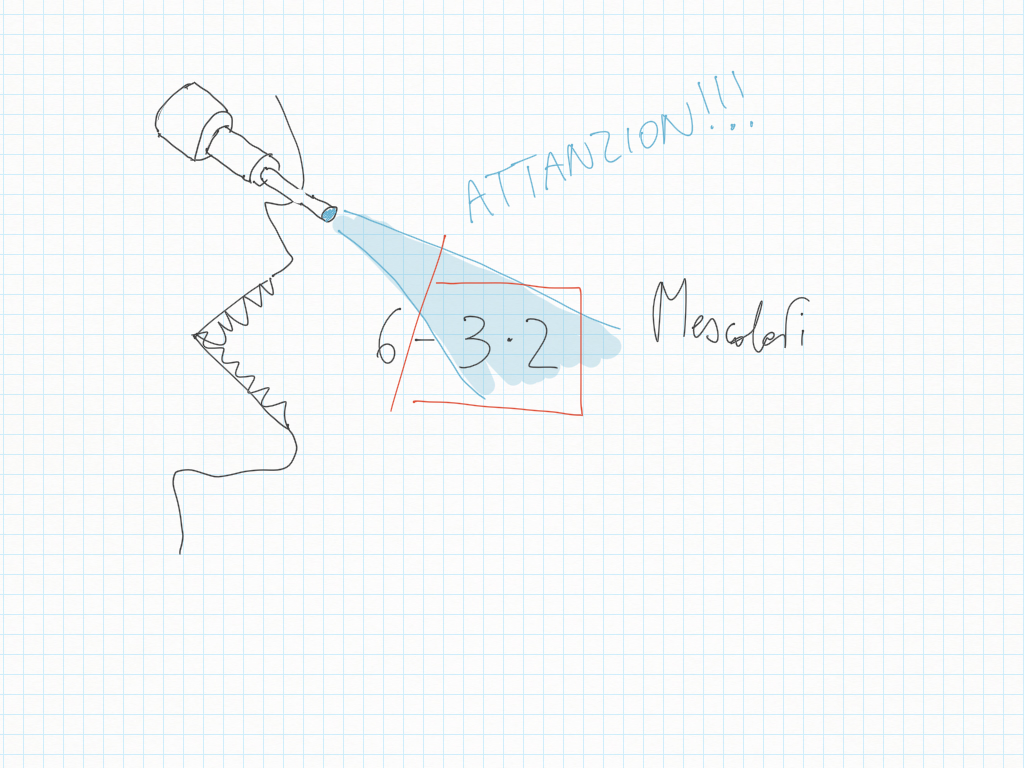
5 Dicembre
Scienze



4 Dicembre


1 Dicembre
Percentuali con numeri decimali


28 Novembre
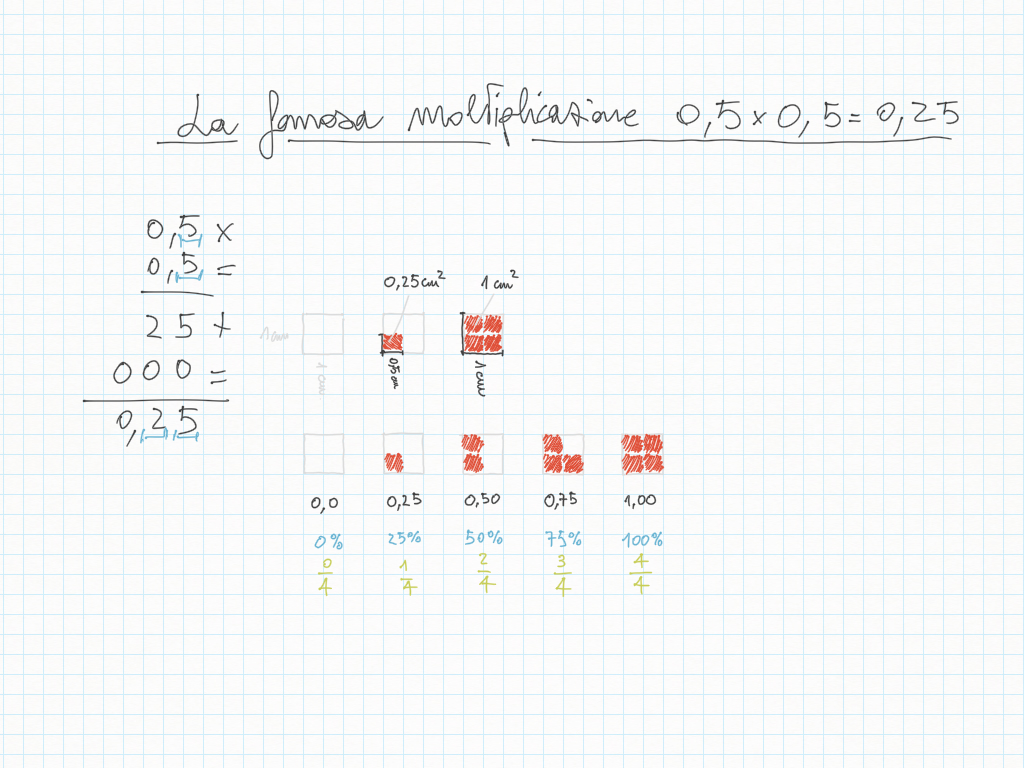


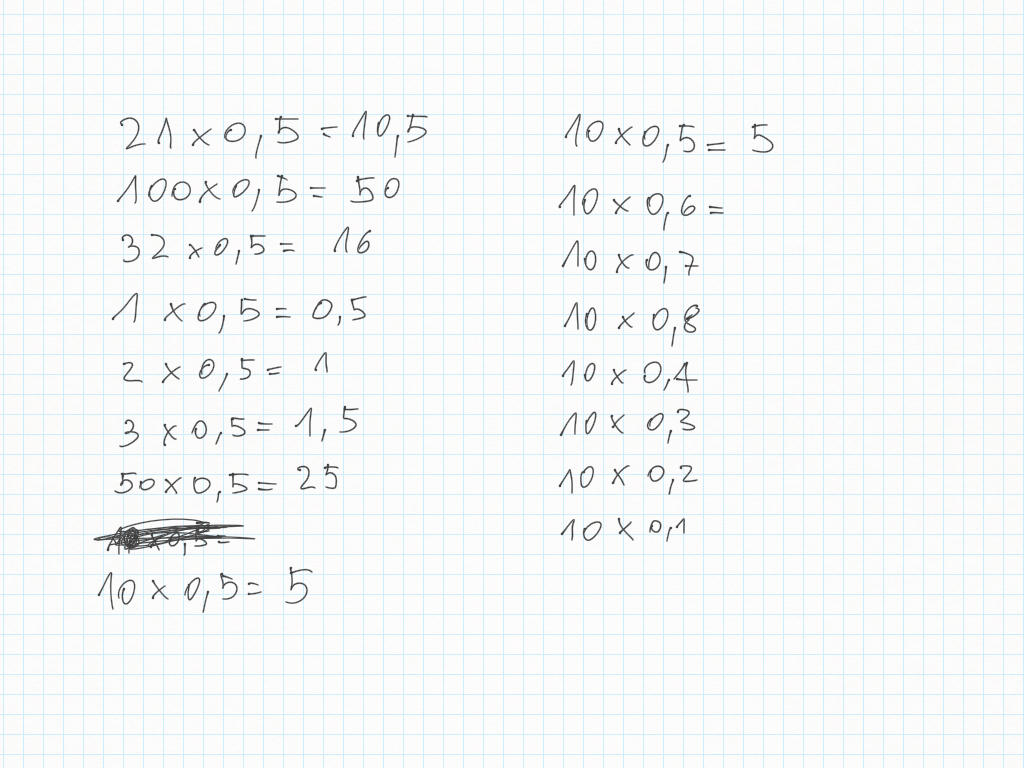
Espressioni corrette nei giorni scorsi
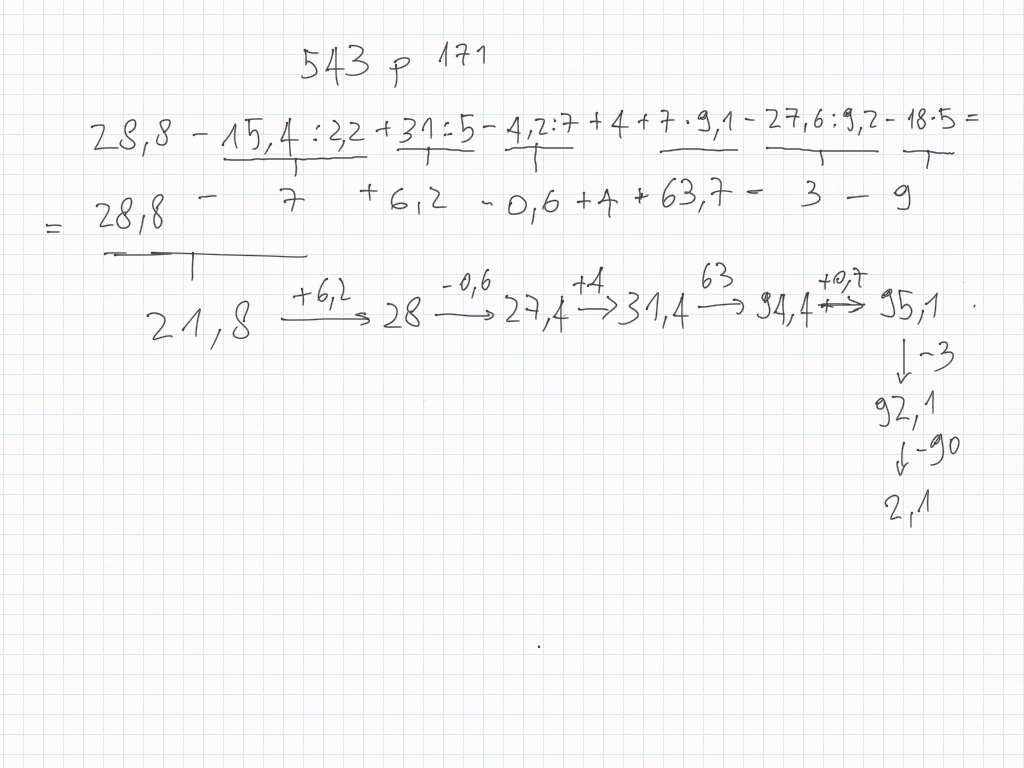

27 Novembre
Prima di procedere a vedere come gli elettroni determinano le reazioni chimiche, proviamo a farci un'idea dell'interazione tra cariche elettriche (uguali o opposte).
A tal scopo giochiamo con l'Hockey Elettrico
23 Novembre
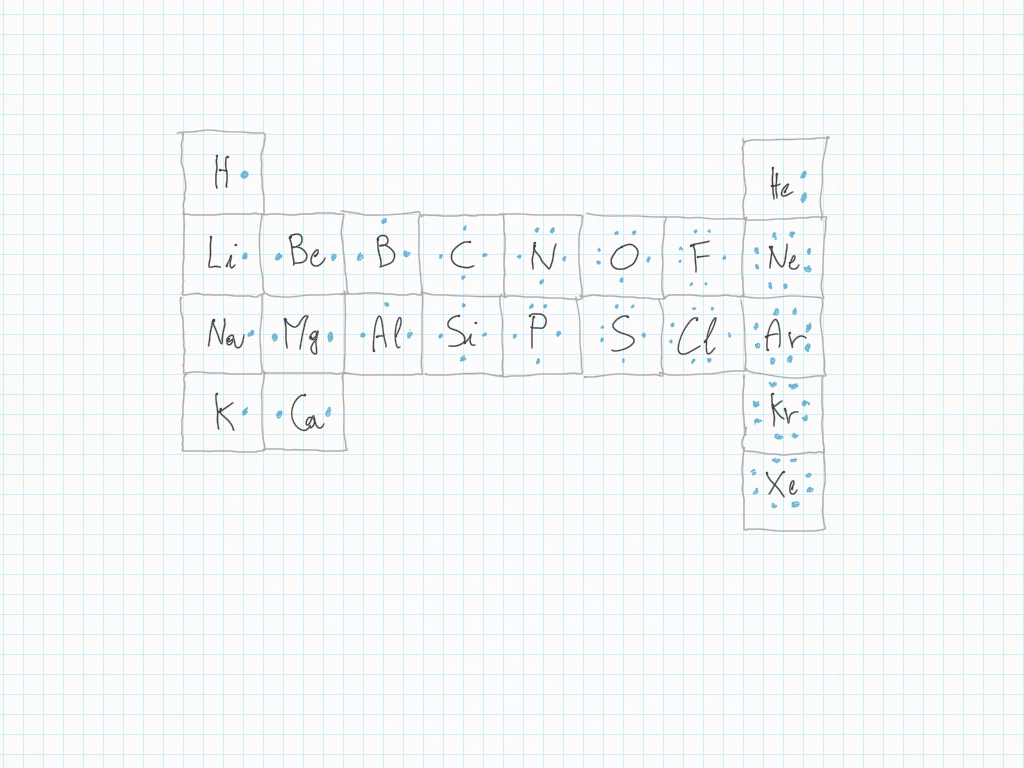
Scienze
Giochiamo adesso a costruire gli atomi aggiungendo pezzi: è quello che avviene/succede all'interno delle stelle durante la fusione nucleare. Le stelle ccostruiscono atomi sempre più grandi a partire da atomi più piccoli. Possiamo fare finta di “essere come le stelle”
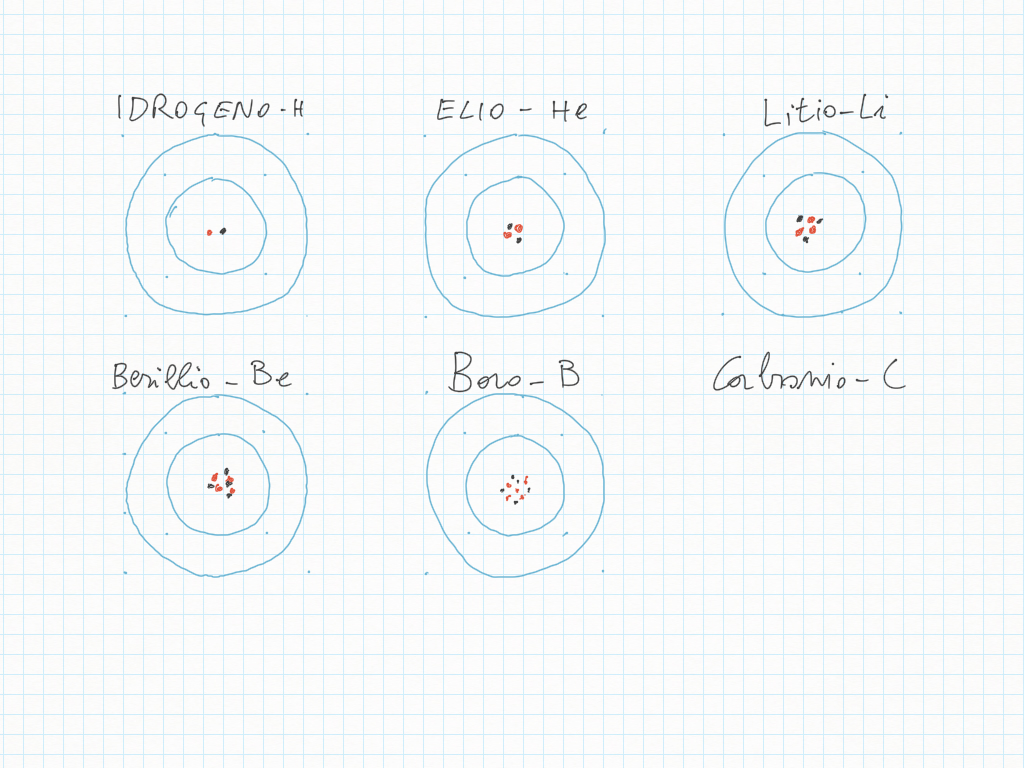
il tipo di atomo è determinato dal numero di protoni;
gli atomi successivi li possiamo leggere in una tavola, detta Tavola Periodica degli Elementi Chimici;
la tavola periodica è il risultato del lavoro di molti anni; fu inventata dal chimico Mendeleev nel 1869;
i protoni sono particelle sub-atomiche con carica positiva;
normalmente nel nucleo ci sono tanti neutroni quanti protoni; quensto non è sempre vero;
quando questo non succede l'elemento chimico corrispondente ha probabilmente degli isotopi, da iso-topos/stesso-luogo; l'Idrogeno, ad esempio, ha tre isotopi, che sono tutti “Idrogeni”, quindi stanno tutti nella stessa casella della tavola periodica:

Parliamo ora degli elettroni.
Nel modello atomico che stiamo usando, quello di Bohr, gli elettroni sono particelle che “risiedono” su uno dei livelli energetici; nelle figure sono disegnati i primi due livelli.
I livelli energetici hanno nome di orbitale e in realtà hanno forme tridimensionali.

I legami chimici, la chimica, sono determinati dagli elettroni: il modo in cui un atomo è fatto all'esterno, dipende dai suoi elettroni.
Gli elettroni sono nello stesso numero dei protoni: i p-rotoni sono carichi p-ositivi, gli elettroni sono negativi. Nel complesso l'atomo è elettricamente neutro.
20 Novembre
Scienze
Atomi successivi
Idrogeno
Matematica
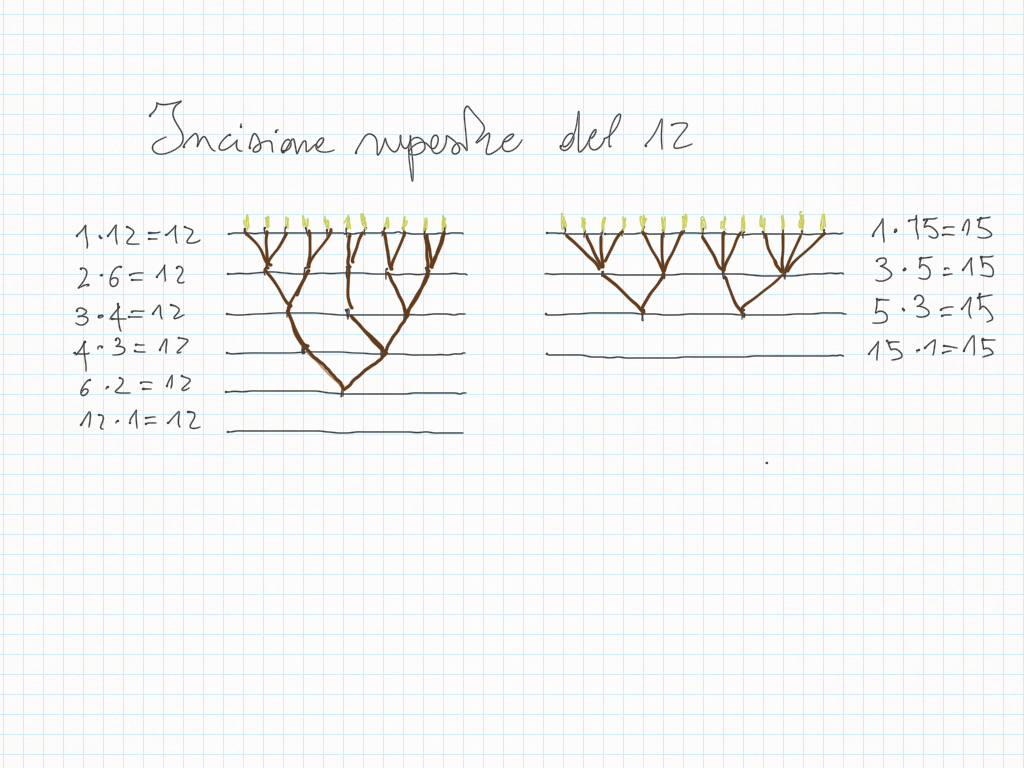
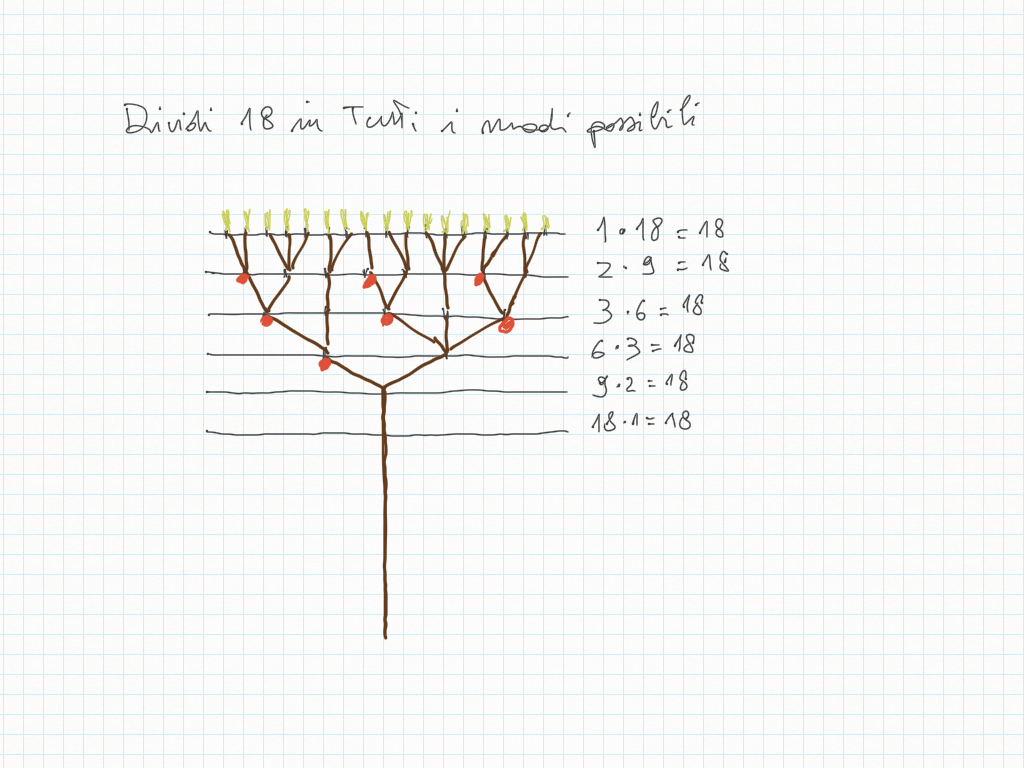
Comportamento inverso/reciproco della moltiplicazione e della divisione
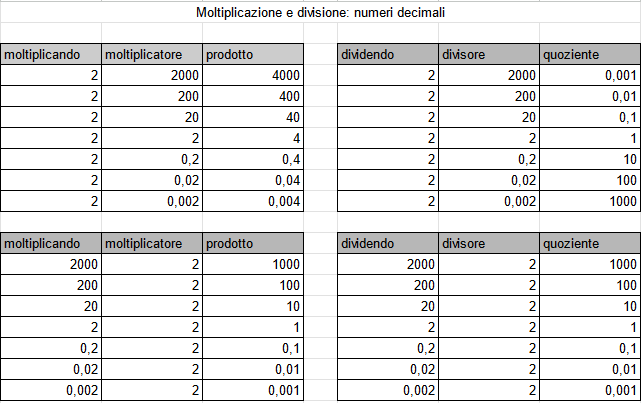
“Significato” delle parole che finiscono in -ando/-anda
Addendo: che deve essere aggiunto. Sottraendo: che deve essere sottratto/a cui deve essere sottratto. Moltiplicando: che deve essere moltiplicato. Dividendo: che deve essere diviso.
Agenda: cose che devono essere agite, cose da fare. ((Mutande: che devono essere cambiate)).
Intelligenza, intus leger, leggere/vedere dentro. Tachipirina, tachis + pyros, veloce + fuoco, abbassare velocemente la febbre.
17 Novembre
Correzione del compito di ieri:
- disegna la moltiplicazione in colonna 18x19:

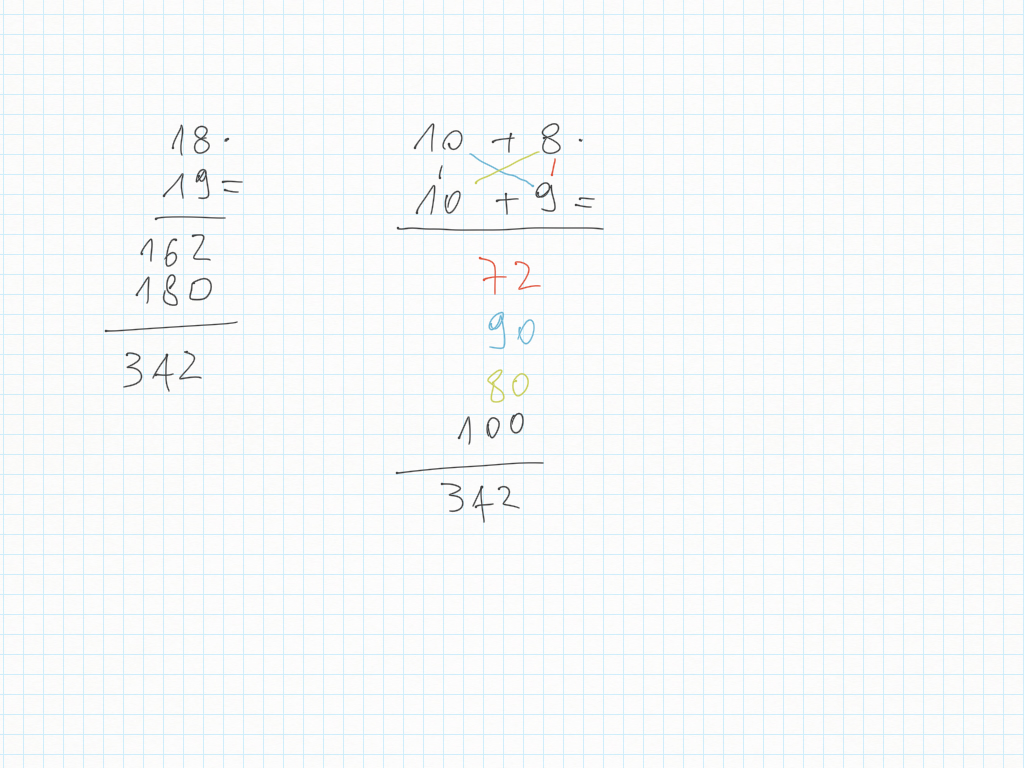
- disegna la moltiplicazione in colonna 22x11:
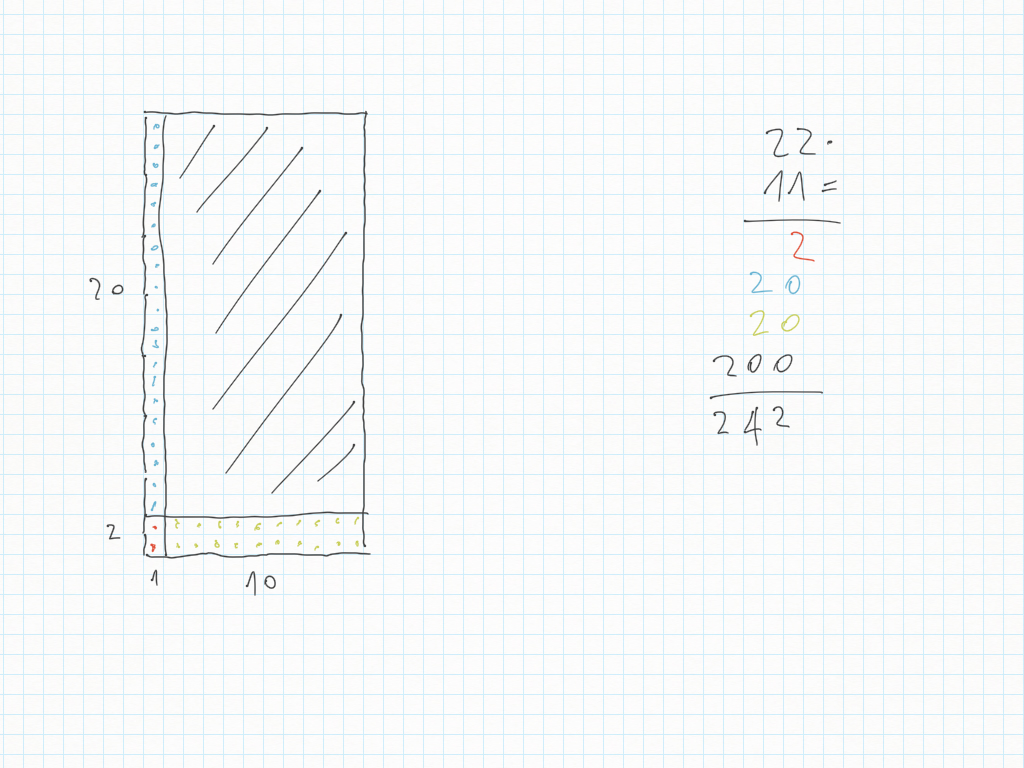
Fine compito.
Disegna la moltiplicazione in colonna 125x33:

16 Novembre
Scienze
Non solo l'atomo è praticamente vuoto, ma il suo nucleo è molto piccolo rispetto alle dimensioni del nucleo intero: se ricordiamo gli ordini di grandezza (https://htwins.net/scale2), l'atomo ha dimensioni di circa 10^(-11) mentre il nucleo di 10^(-14).
0,000 000 000 01 0,000 000 000 000 01
Ne ricaviamo che il nucleo è circa 1'000 volte più piccolo dell'atomo nella sua interezza.
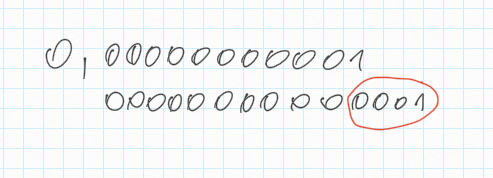
Matematica

14 Novembre

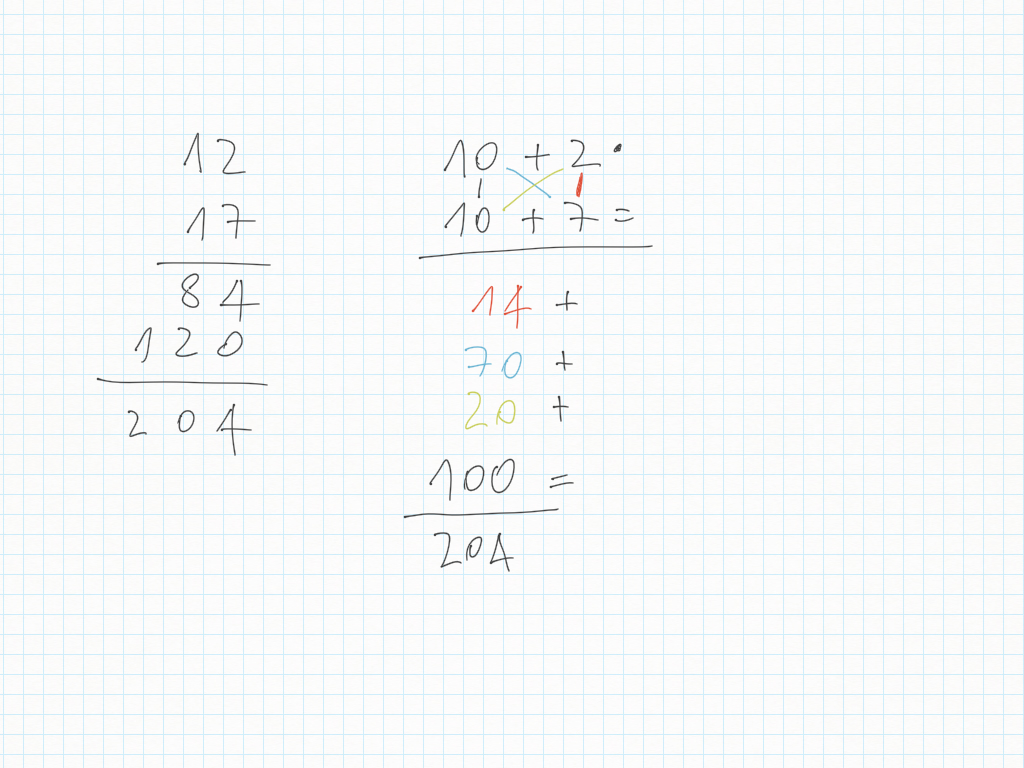
13 Novembre
Matematica


Scienze
Il modello atomico di Bohr
La caratteristica principale dell'atomo, per come lo conosciamo, è che è principalmente vuoto.
Questa caratteristica fu scoperta con un esperimento importante e famoso del 1911.
La simulazione è qui
In questo esperimento viene “dimostrato” che la materia è concentrata nei nuclei degli atomi e che per il resto è vuota.


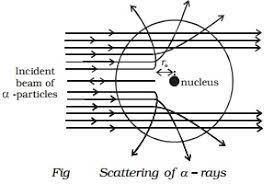

10 Novembre
Compito per lunedì 13 Novembre: ascoltare è importante e possiamo imparare a farlo meglio.
Quindi, di compito, ascoltare con le cuffie, almeno due volte, questo concerto (dura quindici minuti): Telemann: Concerto per Traverso and Recorder in Mi minore, TWV 52:e1 – Bremer Barockorchester.
Lo trovate in due modi:
1) su YouTube qui: https://www.youtube.com/watch?v=2D-y2kJU0lg
2) Su yewtu.be, senza pubblicità: https://yewtu.be/watch?v=2D-y2kJU0lg

9 Novembre
Scienze
Il fatto che il comportamento della materia dipenda da qualcosa che non vediamo è un'idea abbastanza antica: il termine atomo risale all'epoca della Grecia classica.
Democrito è solitamente ritenuto il responsabile di aver usato “per primo” il termine atomo per indicare un componente indivisibile della materia.
Quando, nel 1800, i chimici ripresero/ritrovarono il concetto di atomo, ne ripresero anche il nome.
L'idea antica e quella moderna non hanno in comune “che cosa sia un atomo” ma il fatto che esista qualcosa che combinandosi in modi diversi spiega il comportamento della materia.
Non facciamoci l'idea, un bel po' sbagliata, che i greci avessero “scoperto” gli atomi (attenzione: i greci avevano molte conoscenze di tipo scientifico).
Anche le teorie sulla natura della luce, ad esempio, hanno attinto all'atomo come concetto e non come oggetto.
Matematica
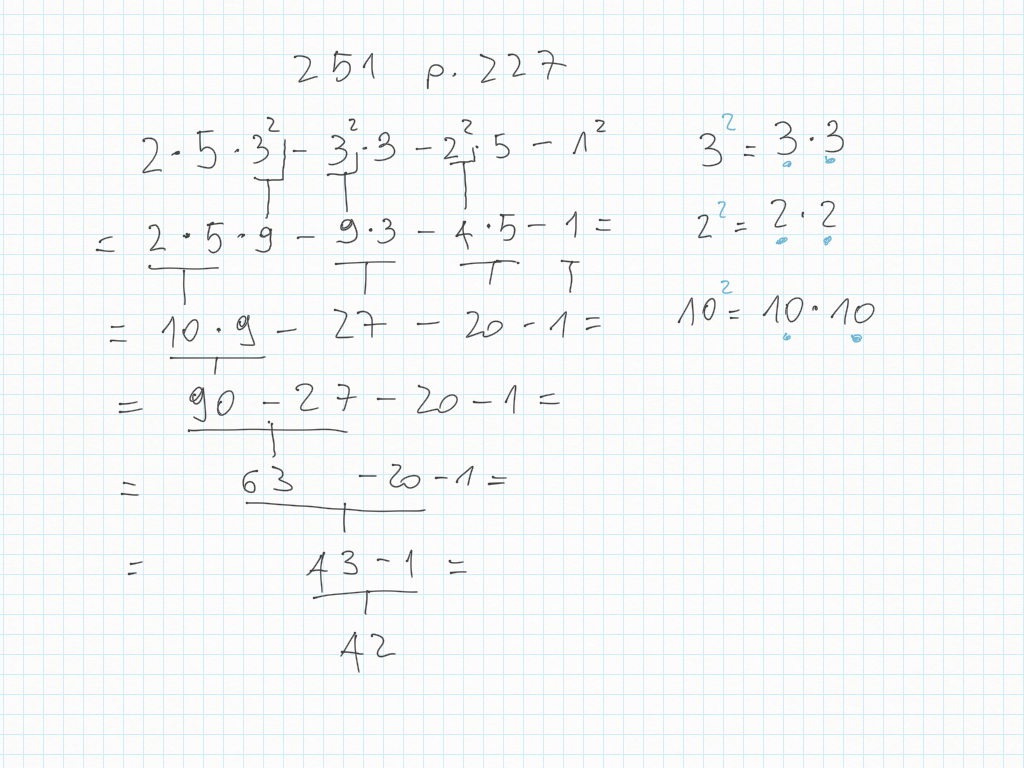

6 Novembre
Scienze
Il concetto che il calore è il movimento delle particelle/atomi/molecole si vede anche nel calore sprigionato dallo sfregamento:

Matematica

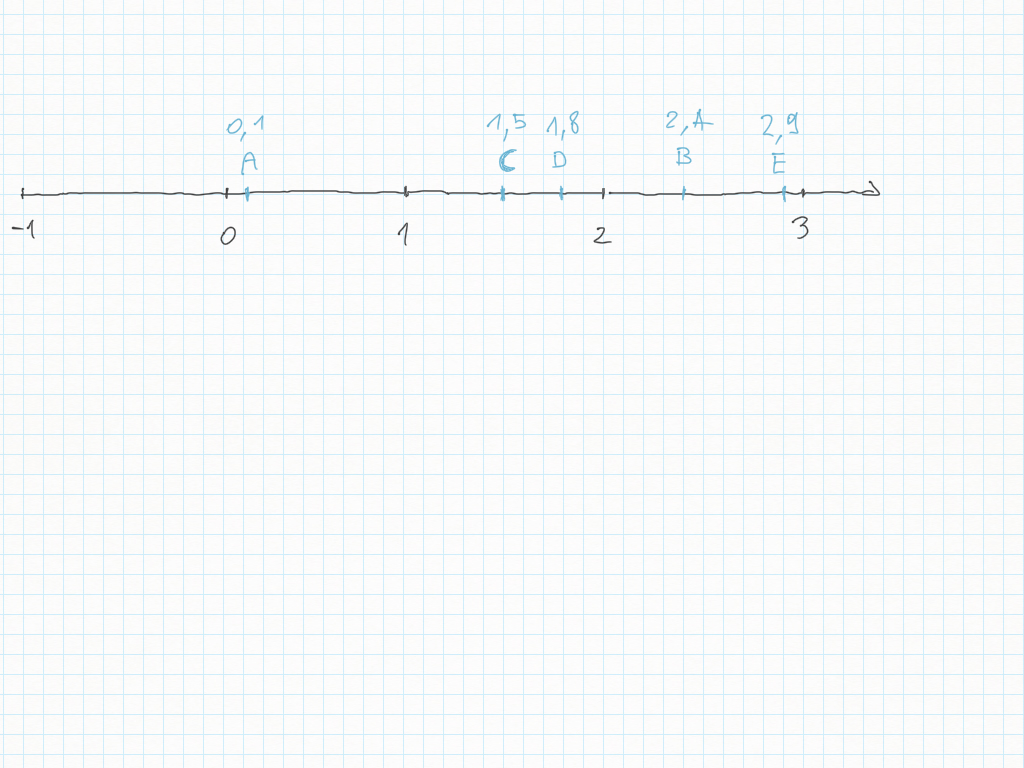
2 Novembre
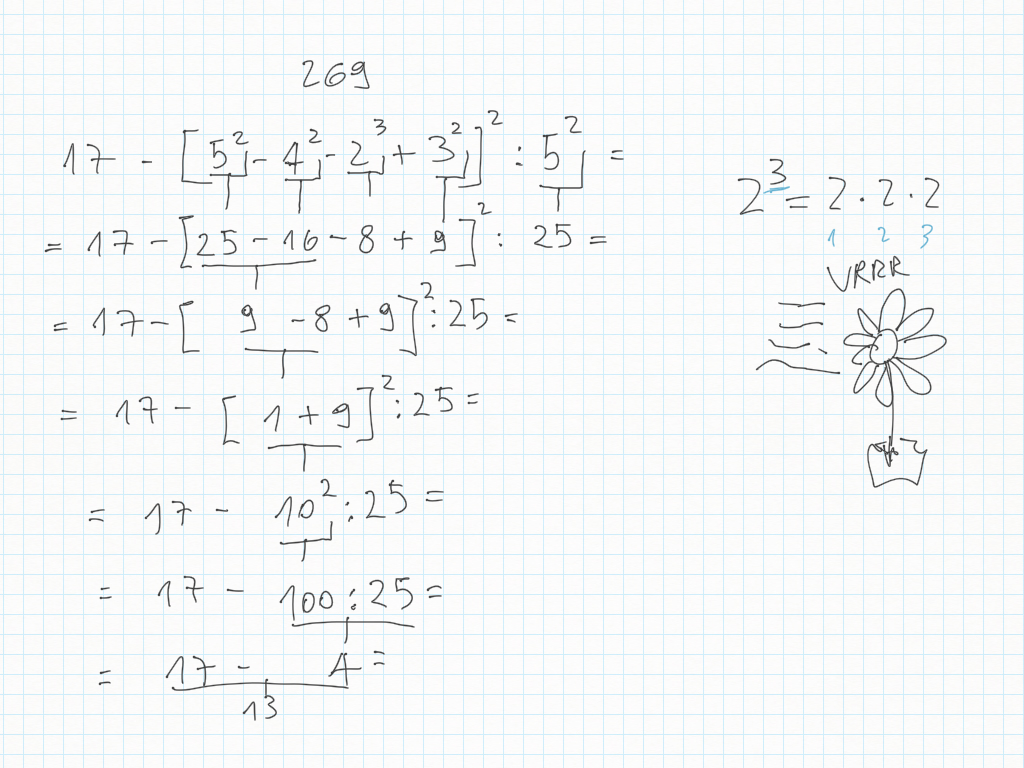

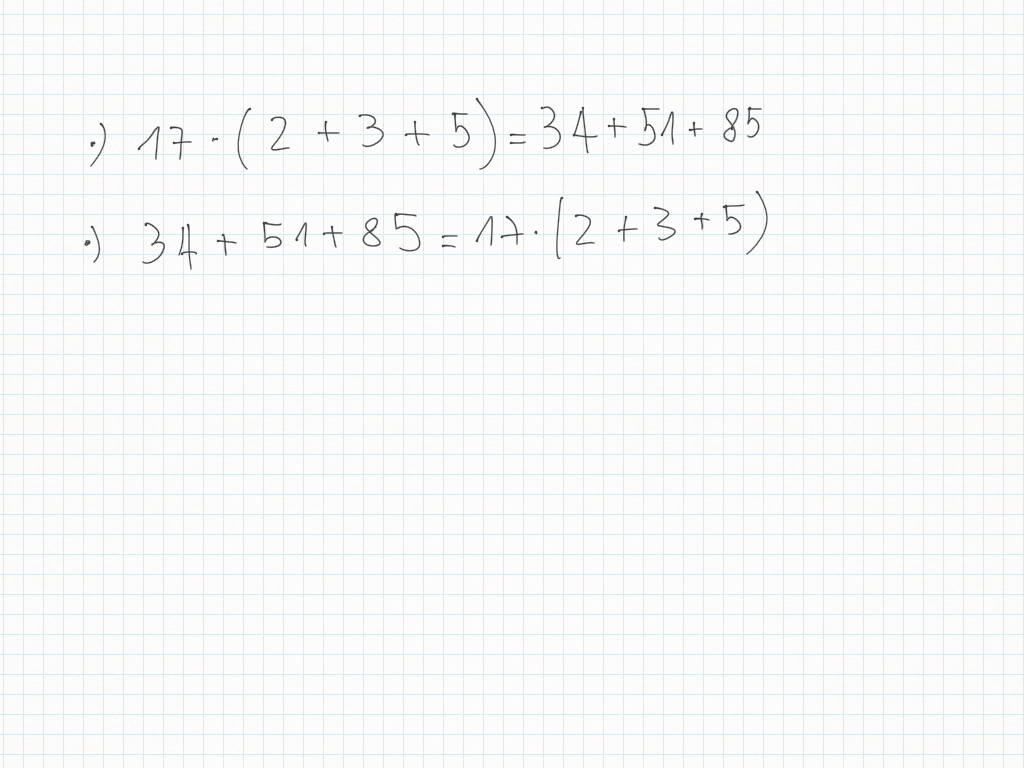

31 Ottobre
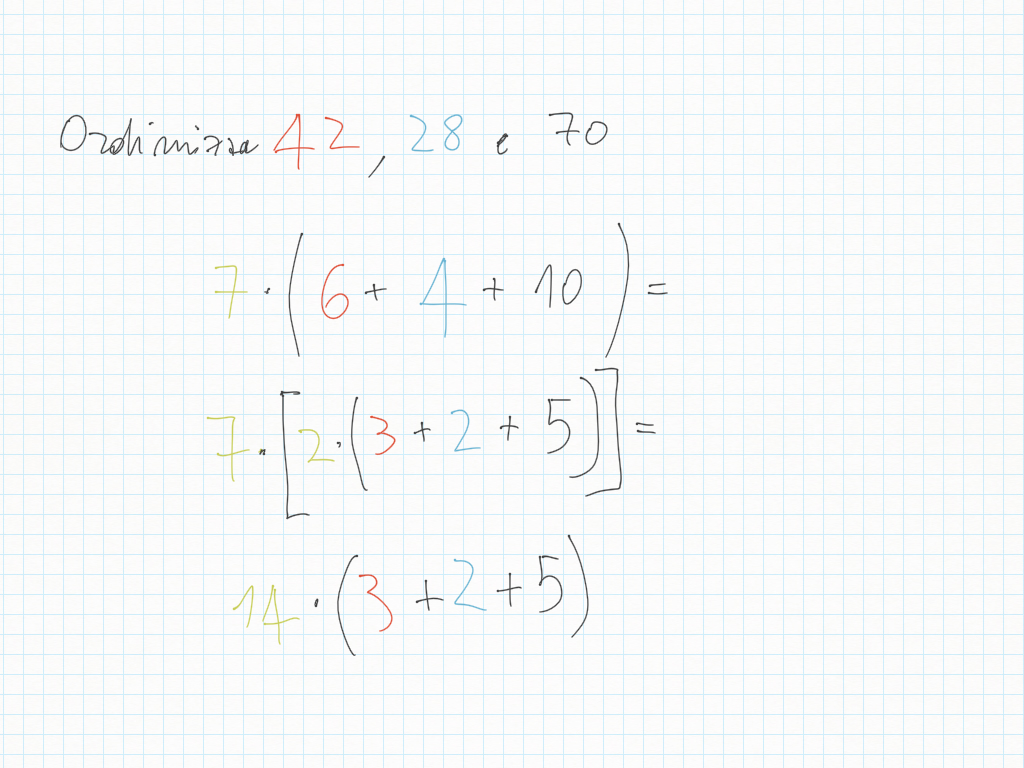

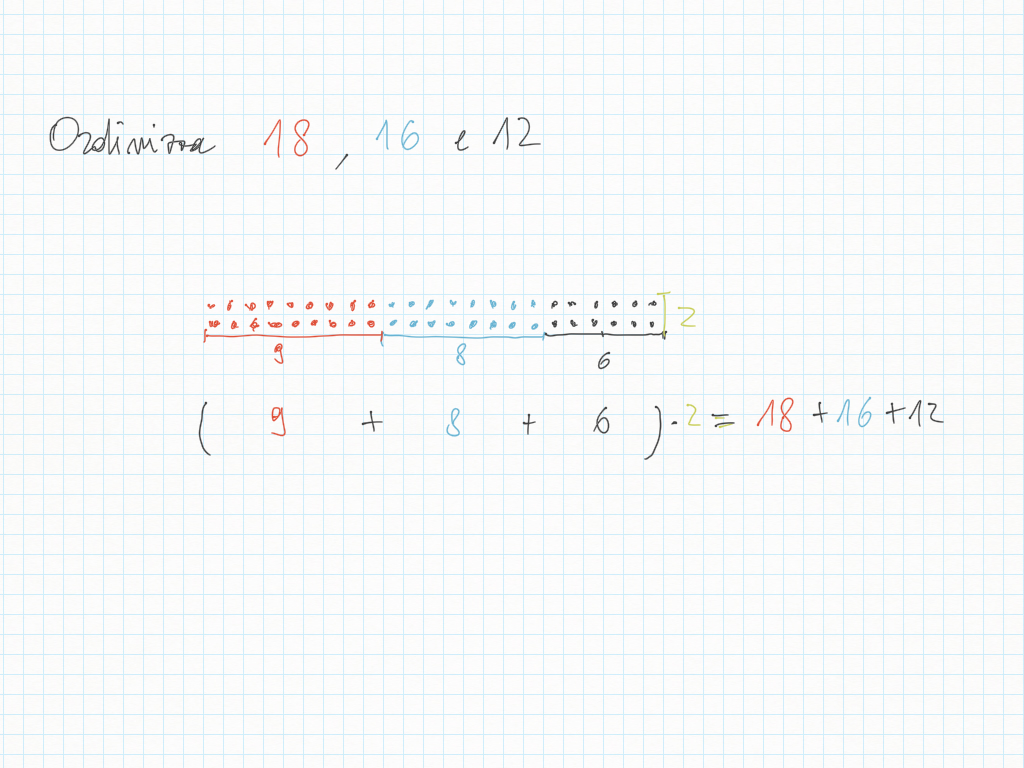

30 Ottobre
Scienze
https://phet.colorado.edu/sims/html/states-of-matter/latest/states-of-matter_all.html
Una osservazione che non si riesce ad effettuare è la seguente: durante i passaggi di stato, la temperatura non cambia.
Per esempio: l'acqua sta bollendo nella pentola, quindi ha una temperatura di 100°Celsius; aumentiamo la fiamma e vediamo l'acqua bollire con maggiore energia MA la temperatura è sempre di 100°C.
Al limite evaporerà tutta prima. L'acqua che bolle NON HA una temperatura superiore ai 100°C; il ghiaccio che si scioglie NON HA una temperatura superiore agli 0°C.
Fine dell'osservazione.
Approfittiamo per spiegare che differenza c'è tra gradi centigradi e gradi Celsius: i gradi Celsius hanno come riferimento la temperatura di congelamento e di ebollizione dell'acqua e, come sappiamo, danno un intervallo da 0 a 100. Anche i gradi Kelvin hanno lo stesso intervallo, da 273,15 a 373,15: entrambi sono centigradi (le tacche sono lunghe uguali).
Tra i due estremi, congelamento ed ebollizione, ci sono cento (100) suddivisioni.
Matematica


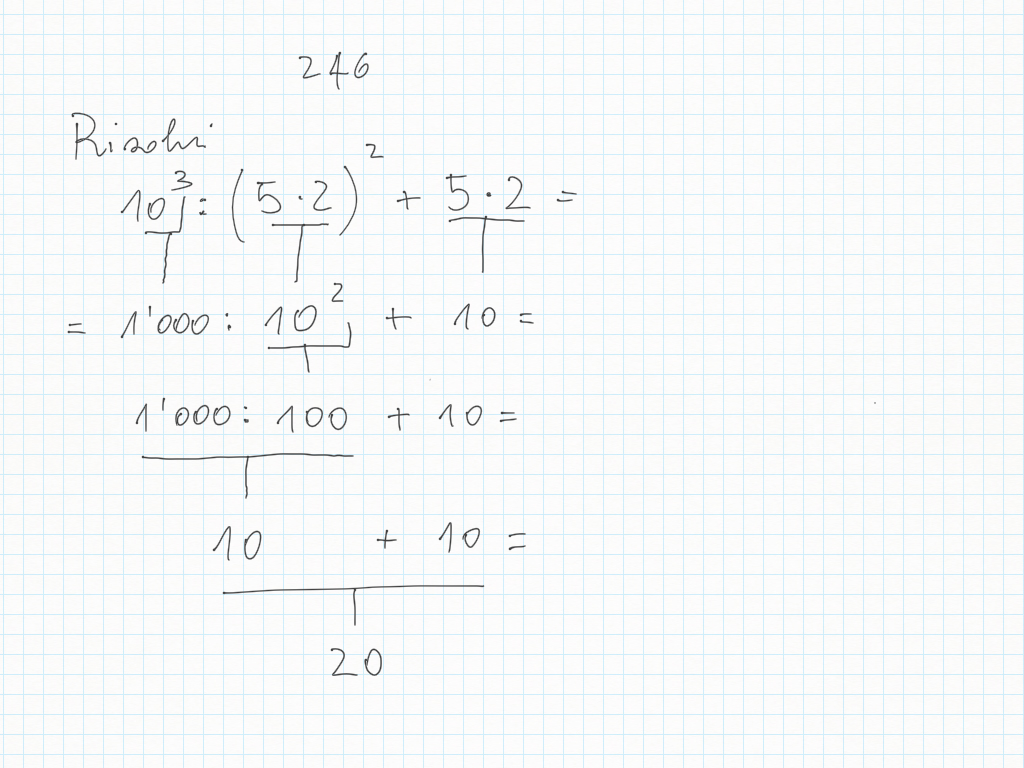
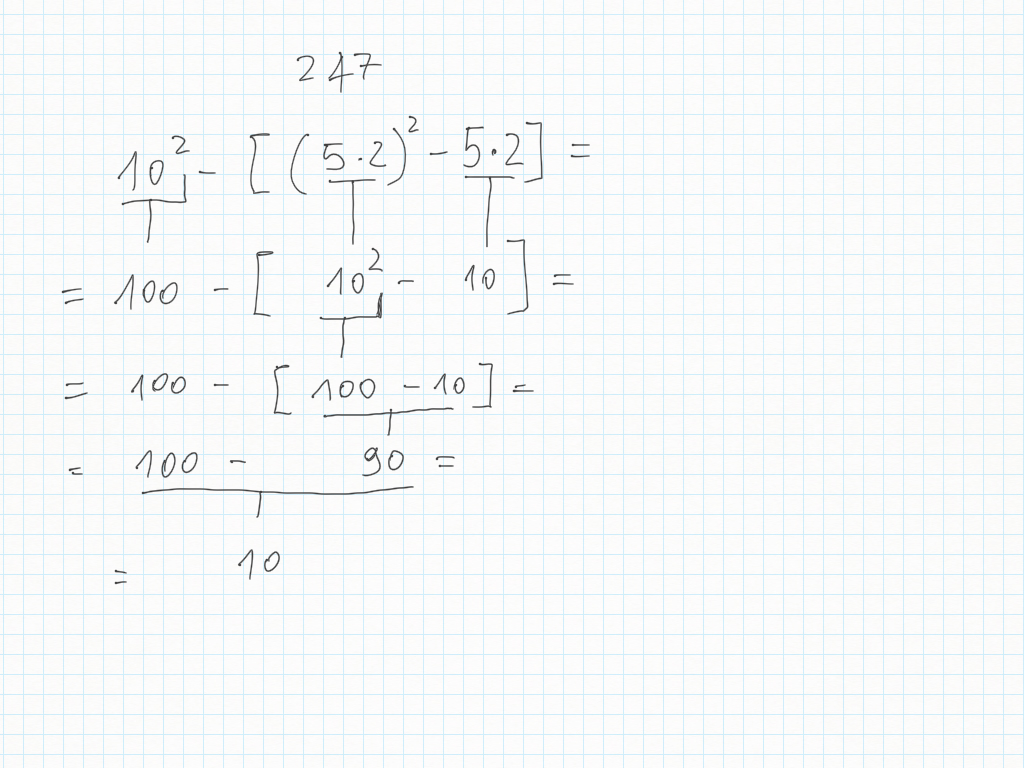
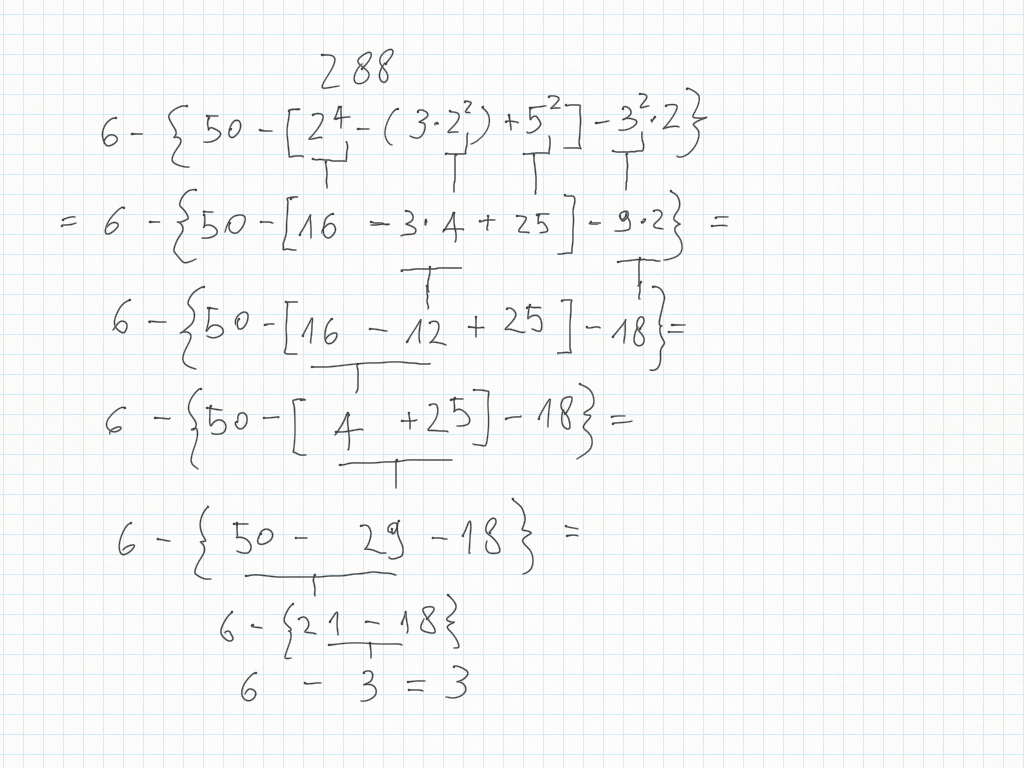
27 Ottobre



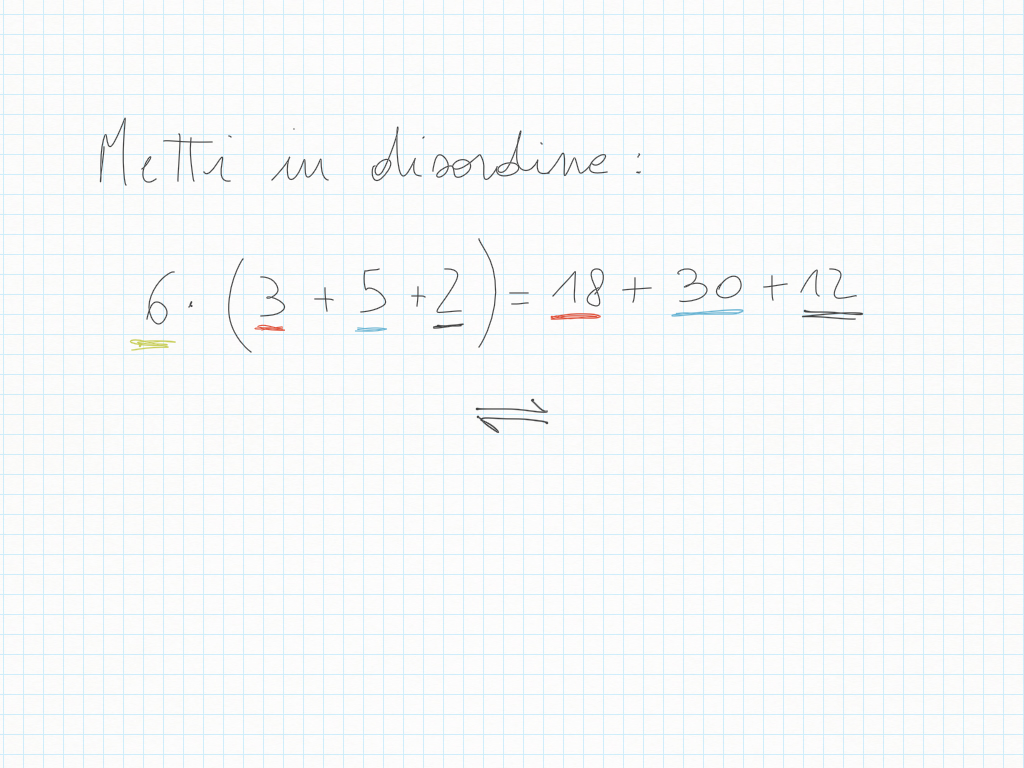
26 Ottobre
Scienze
Il calore e gli stati della materia
https://phet.colorado.edu/sims/html/states-of-matter-basics/latest/states-of-matter-basics_all.html
L'animazione che abbiamo usato a scuola sugli stati della materia mostra alcune cose banali e altre meno banali:
fornendo calore a un materiale capita che cambi il suo stato di aggregazione (solido/liquido/gas); questo accade anche sottraendo calore, cioè raffreddando. Il calore si può sia aggiungere che sottrarre e “va a finire” in moto/movimento delle particelle/molecole/atomi che compongono il materiale.
aumentando la pressione/comprimendo, la temperatura aumenta: questo vale per i gas. Il simmetrico di questo fenomeno è la dilatazione di un gas che viene scaldato: è il caso della mongolfiera.

Matematica
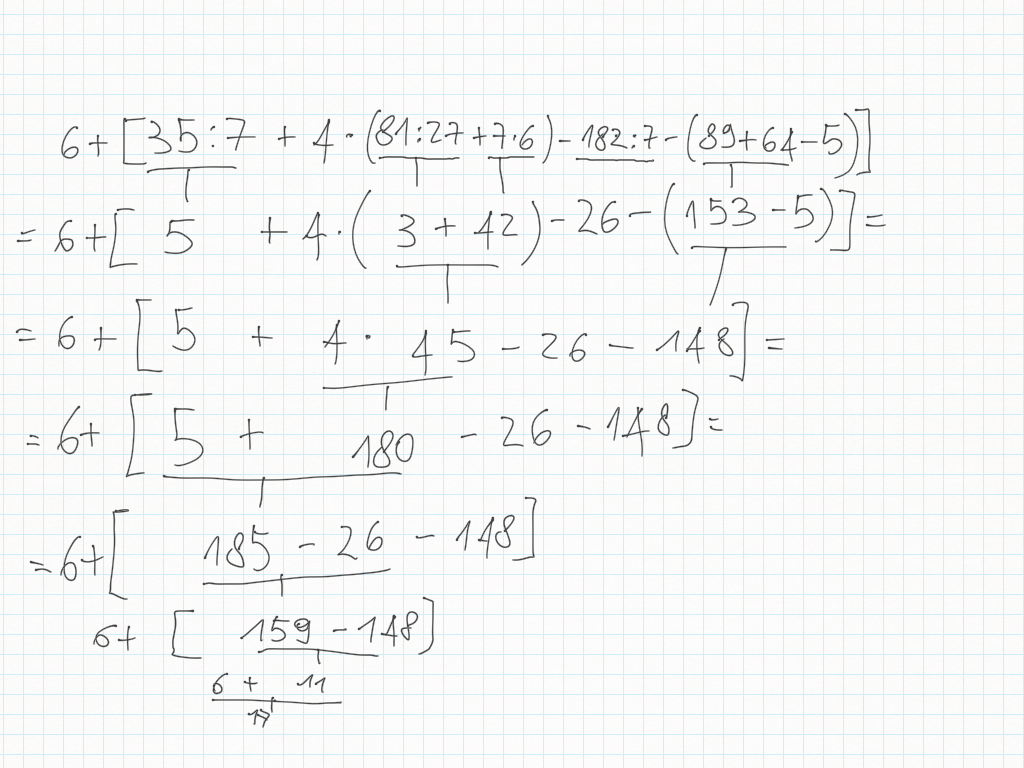


24 Ottobre
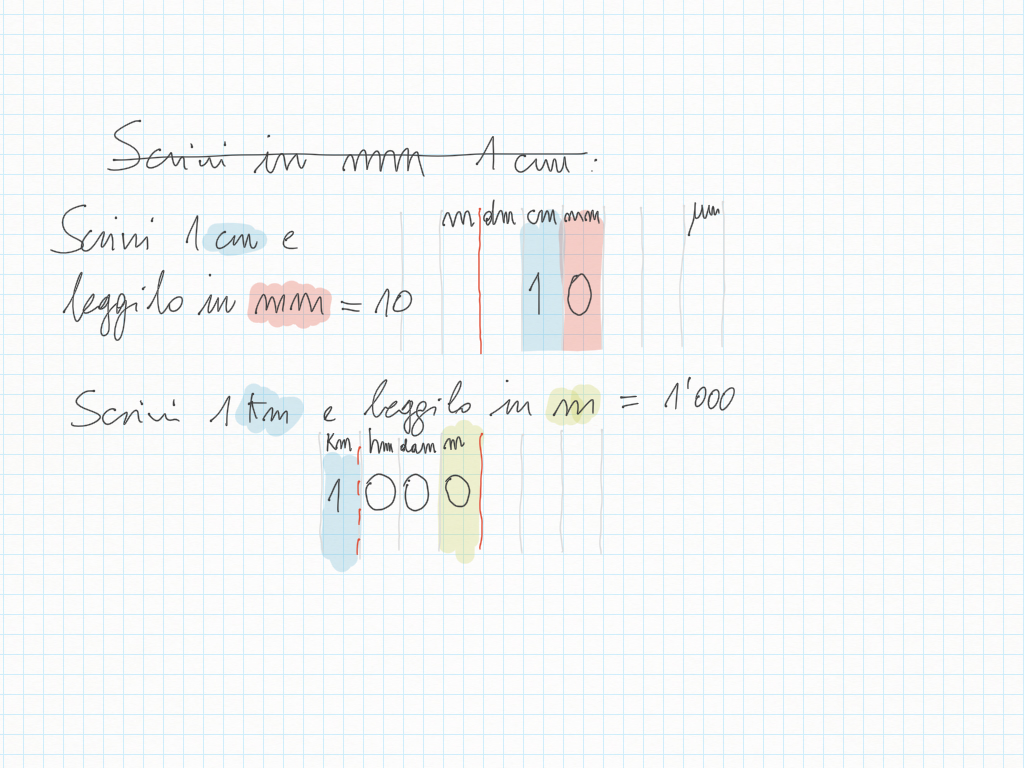


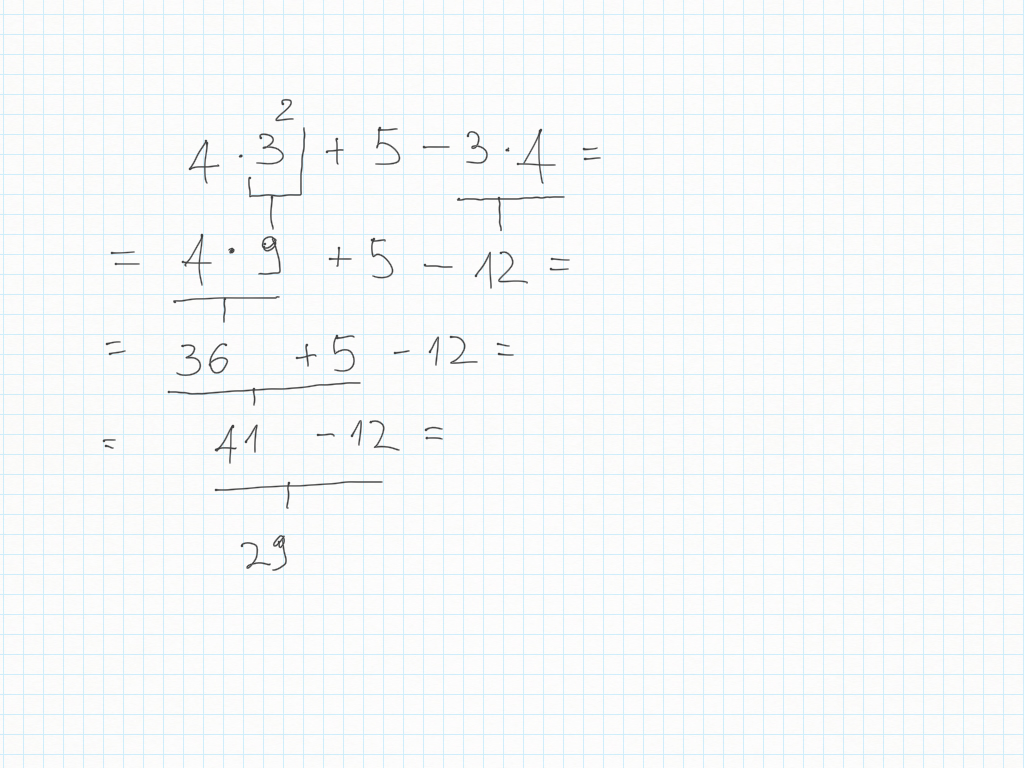
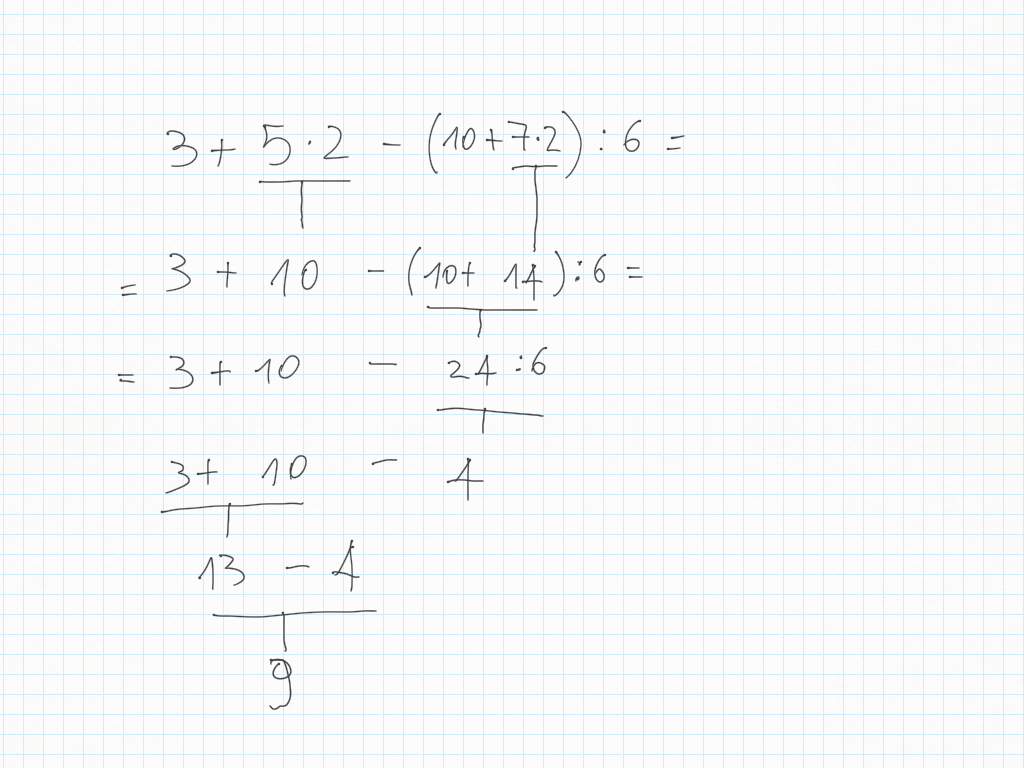
23 Ottobre
Matematica


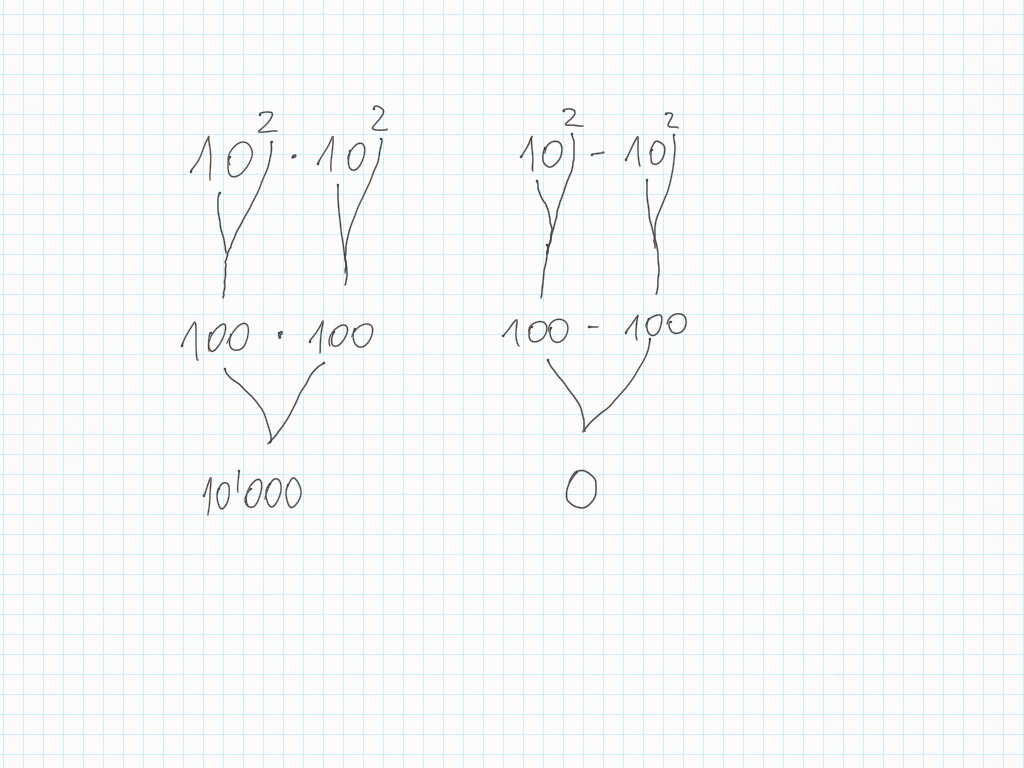
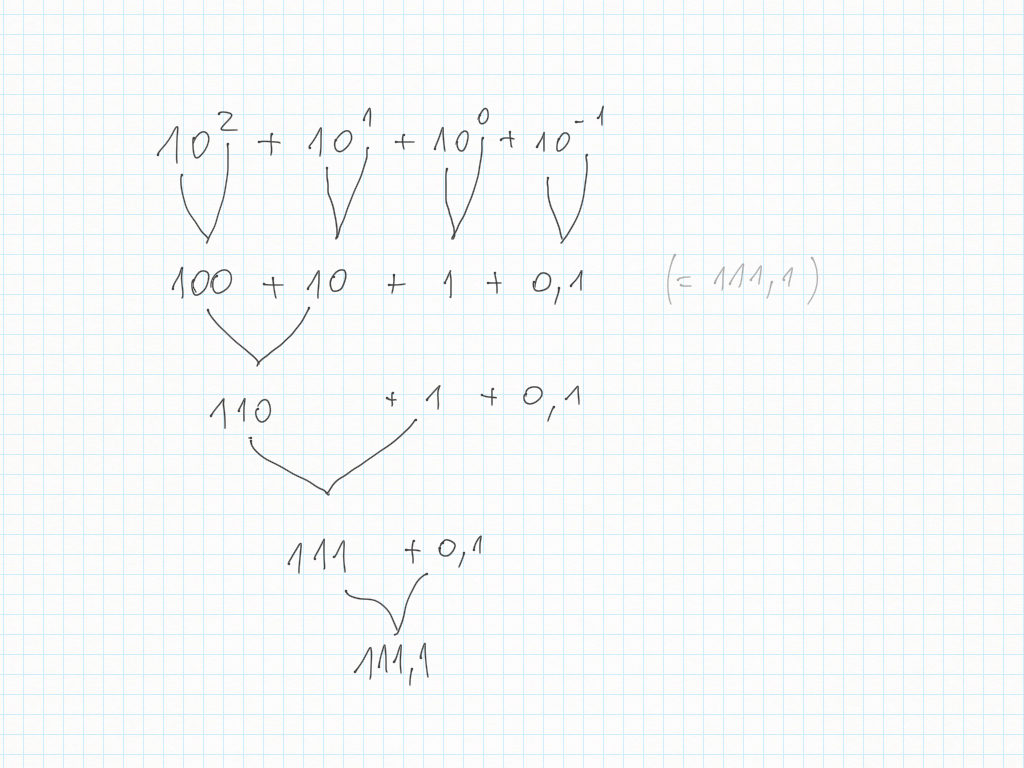
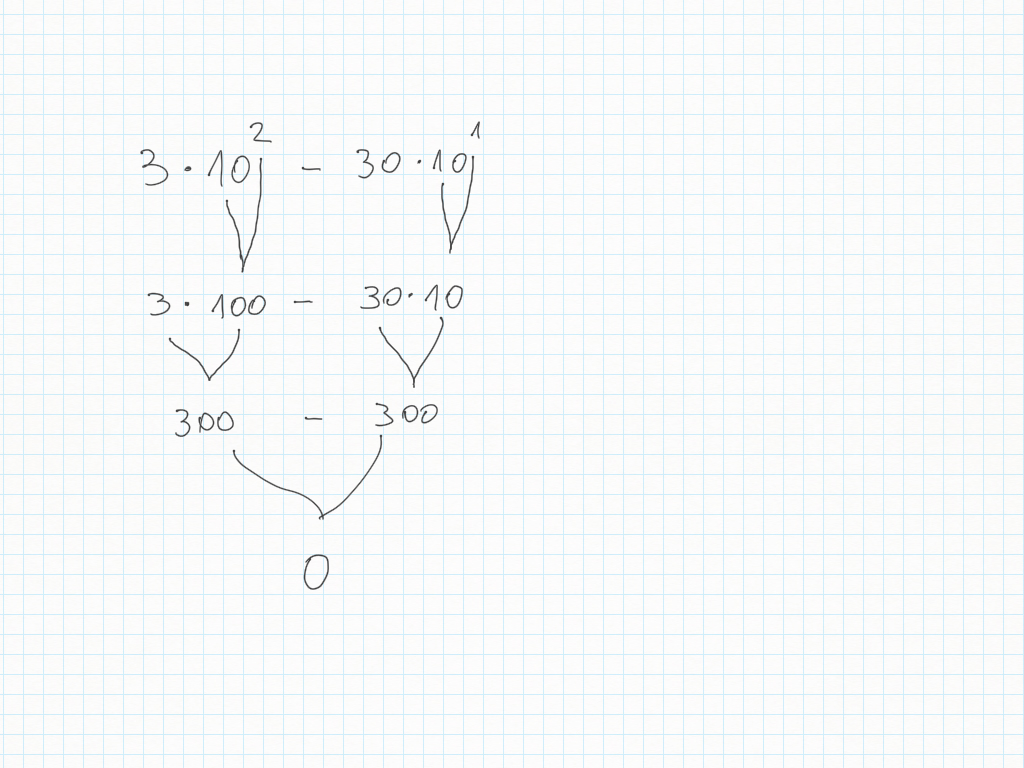
20 Ottobre


19 Ottobre
Scienze
La massa e il peso
Il kg, che noi solitamente utiliziamo per il peso, in realtà indica più propriamente la massa.
Ma, cos'è la massa? La massa è qualcosa di difficile da o spostare o fermare.
Immaginiamo un universo con solo la Terra, sospesa lì, nello spazio: essa non ha peso. Infatti, se aggiungiamo una bilancia poi non abbiamo un piano su cui appoggiare bilancia e Terra, per pesare.
Anche se non possiamo pesarla la Terra continua ad avere la propria massa; anche la massa viene espressa in kg.
La difficoltà a spostare o fermare una massa si chiama inerzia: se il peso lo sperimentiamo facilmente, ad esempio quando mettiamo un sasso in tasca, la massa la sperimentiamo quando spingiamo o fermiamo qualcuno sull'altalena. Sull'altalena, infatti, il peso “è tenuto” dalle catene, mentre la massa oppone resistenza.
La differenza tra peso e massa è importante; entrambi si misurano in kg.
Matematica
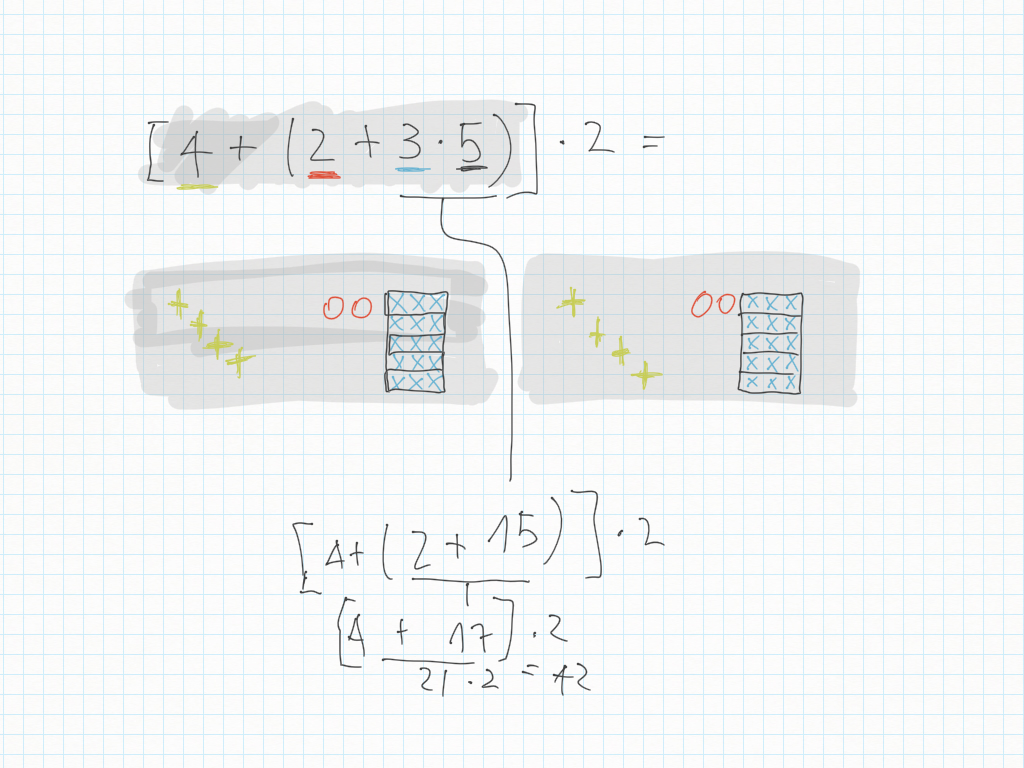
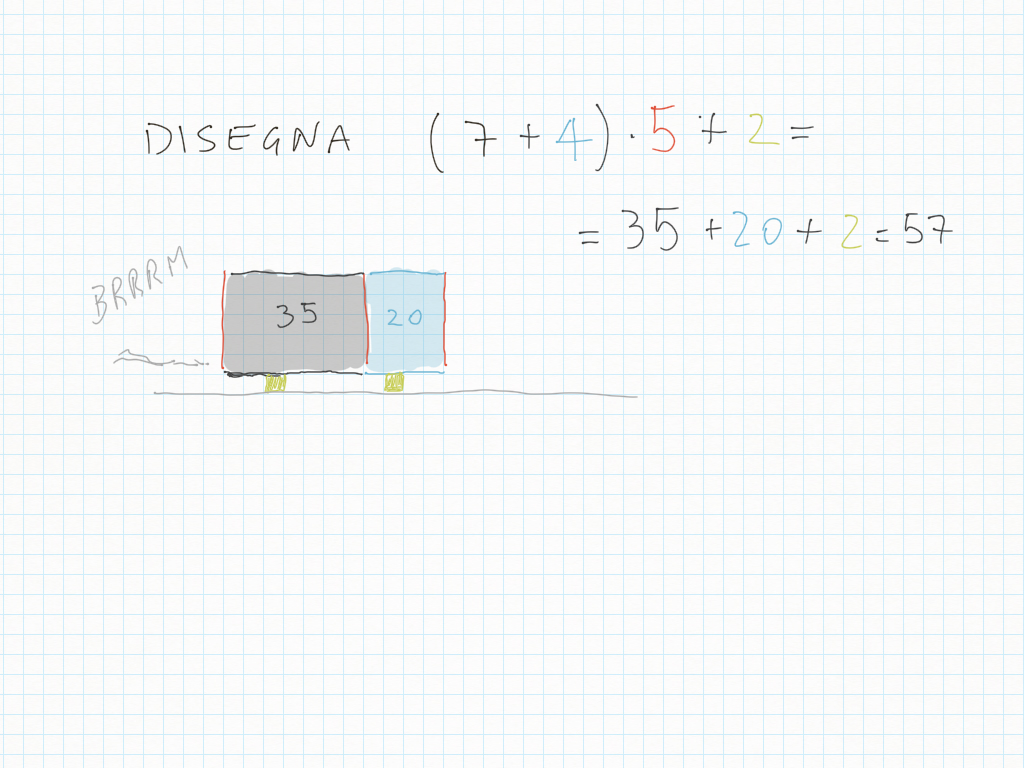
Espressioni

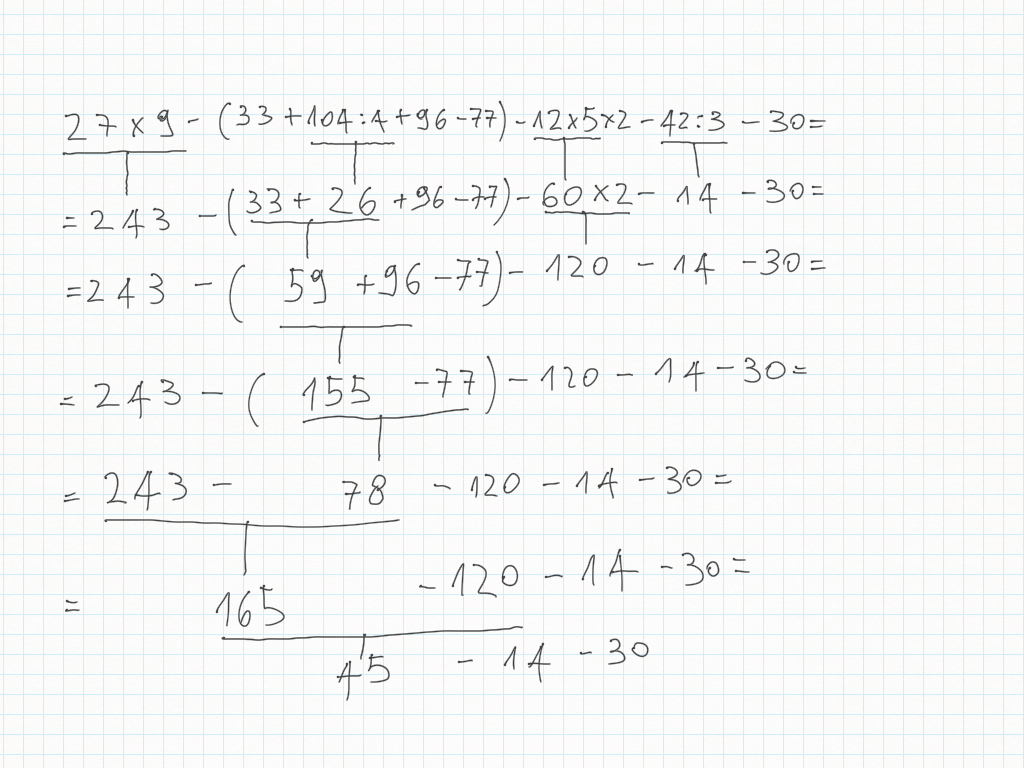

16 Ottobre
Scienze
Riguardo le unita di misura fondamentali diremo questo:
una mole consiste di 6,022×10^23 atomi o molecole (secondo il tipo di sostanza); se un atomo o una molecola hanno peso atomico/molecolare di 2 (è un esempio), una mole peserà 2 grammi. La mole permette ai chimici di contare le molecole usando la bilancia. 18 grammi di H2O contengono 6,022x10^23 (600'000 miliardi di miliardi) perchè il peso molecolare dell'acqua è 18.
i gradi kelvin indicano la temperatura assoluta. Cosa significa? Esiste una temperatura detta zero assoluto, che corrisponde a -273,15°Celsius, alla quale le molecole/gli atomi non possono essere più fermi di così. Per esempio, nel ghiaccio sono più ferme che nell'acqua bollente o nel vapore: allo zero assoluto sono completamente immobili.
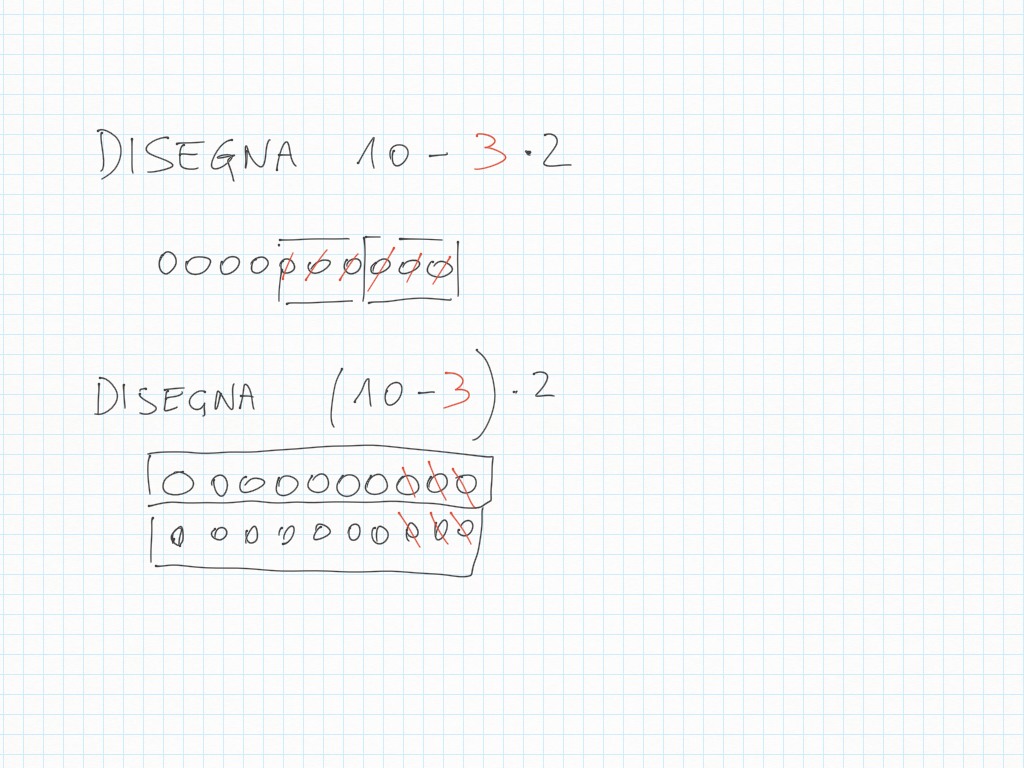
Matematica
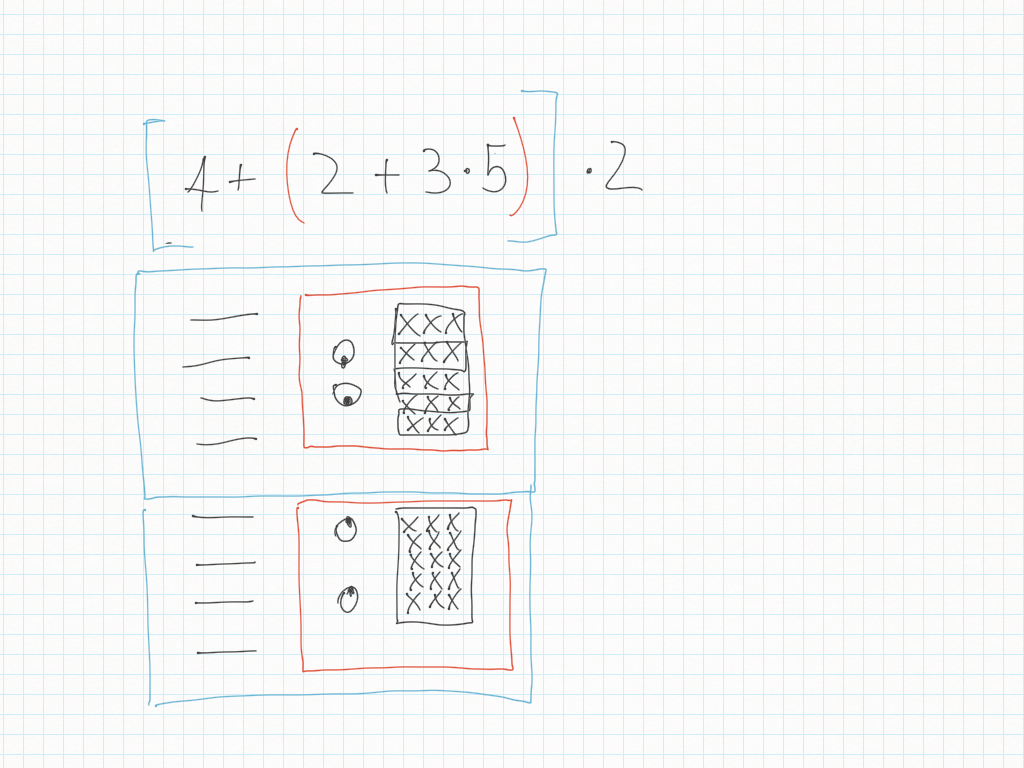
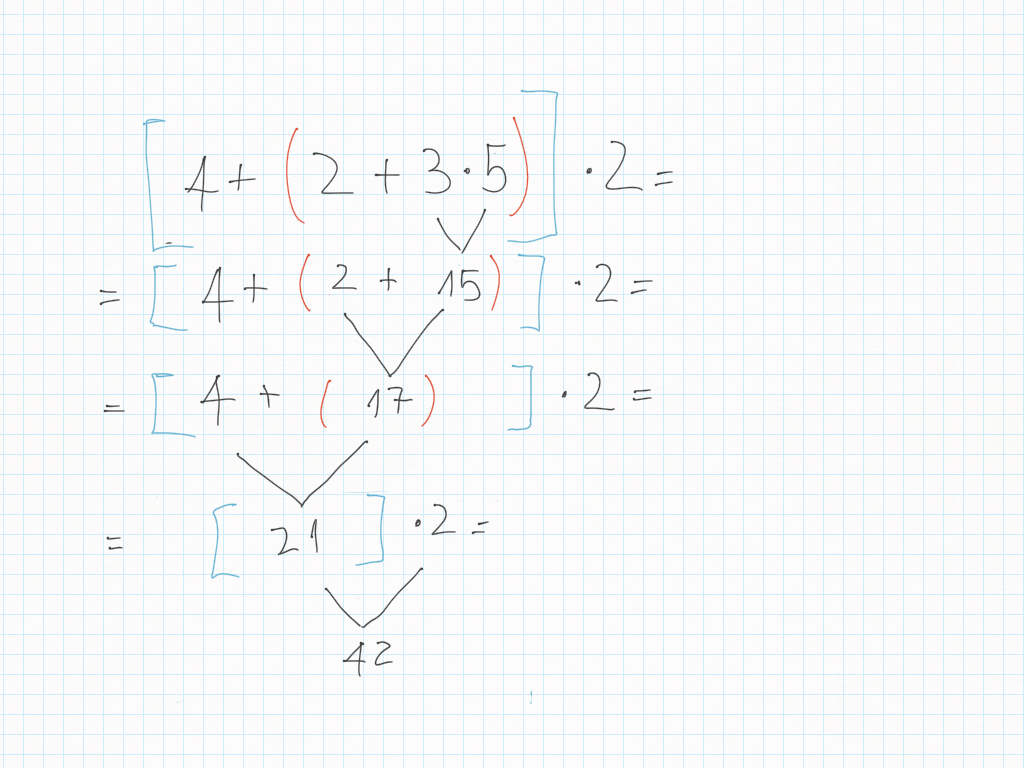

12/13 Ottobre
Scienze
Quando si eseguono degli esperimenti si misurano delle quantità, delle grandezze.
Alcune di queste grandezze sono derivate:
- la velocità è derivata da tempo e spazio;
- la corrente elettrica da carica elettrica e tempo.
Altre grandezze sono fondamentali cioè non sono derivate:
- lunghezza;
- massa;
- tempo;
- temperatura.
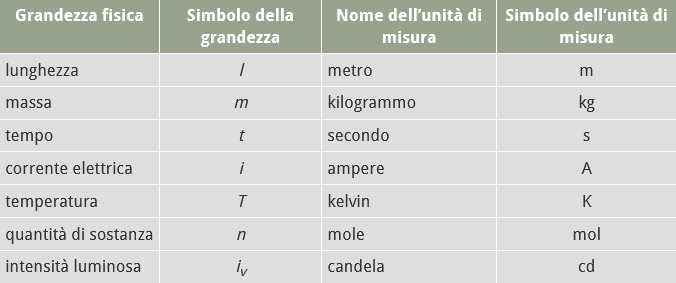
Nel Sistema Internazionale di misura si è deciso di utilizzare questa tabella delle grandezze fondamentali:
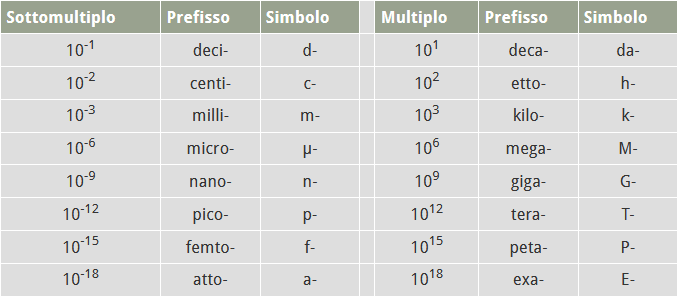
Questi sono i prefissi dei multipli e sottomultipli:
Matematica
Espressioni
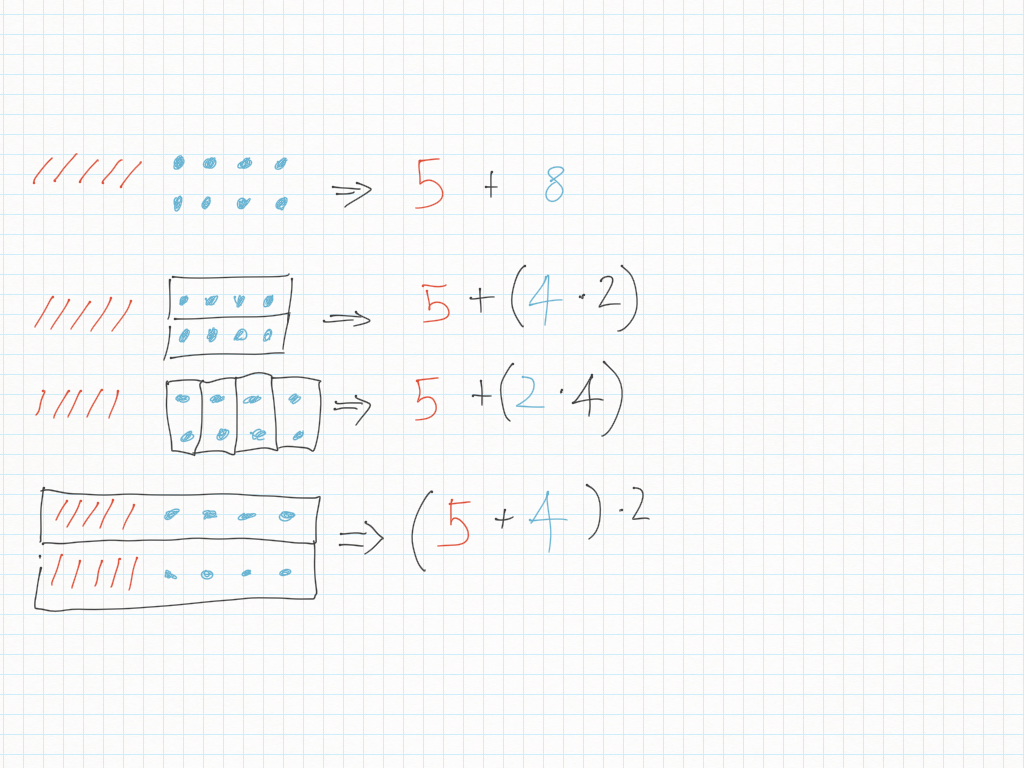
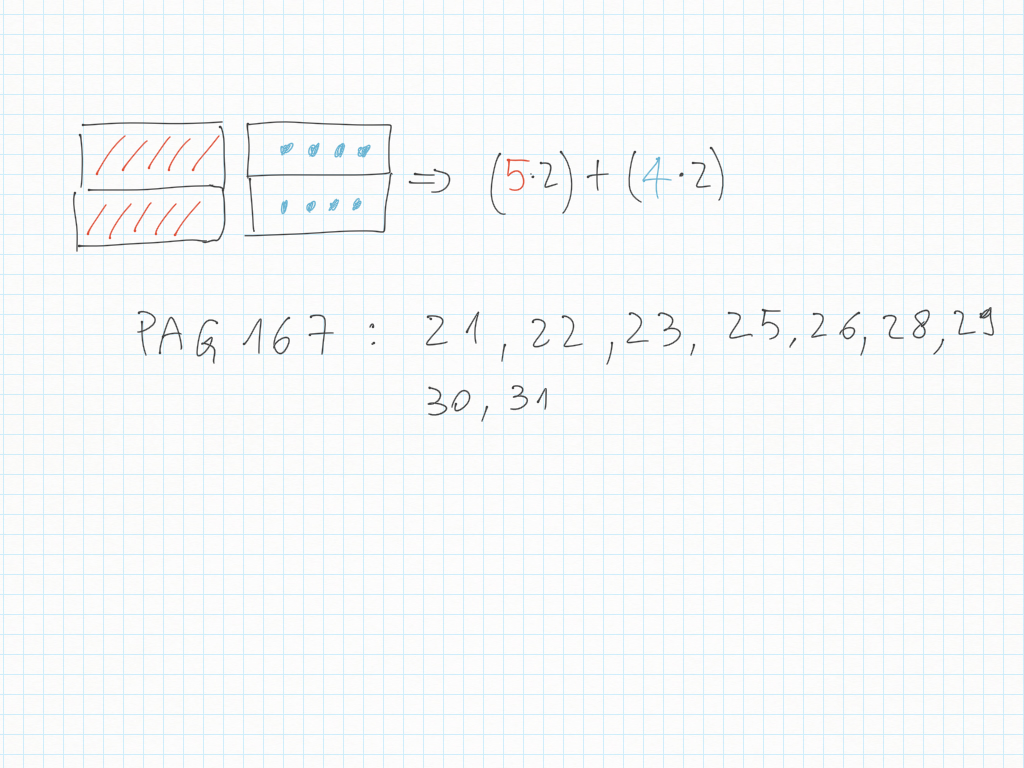

10 Ottobre
Espressioni
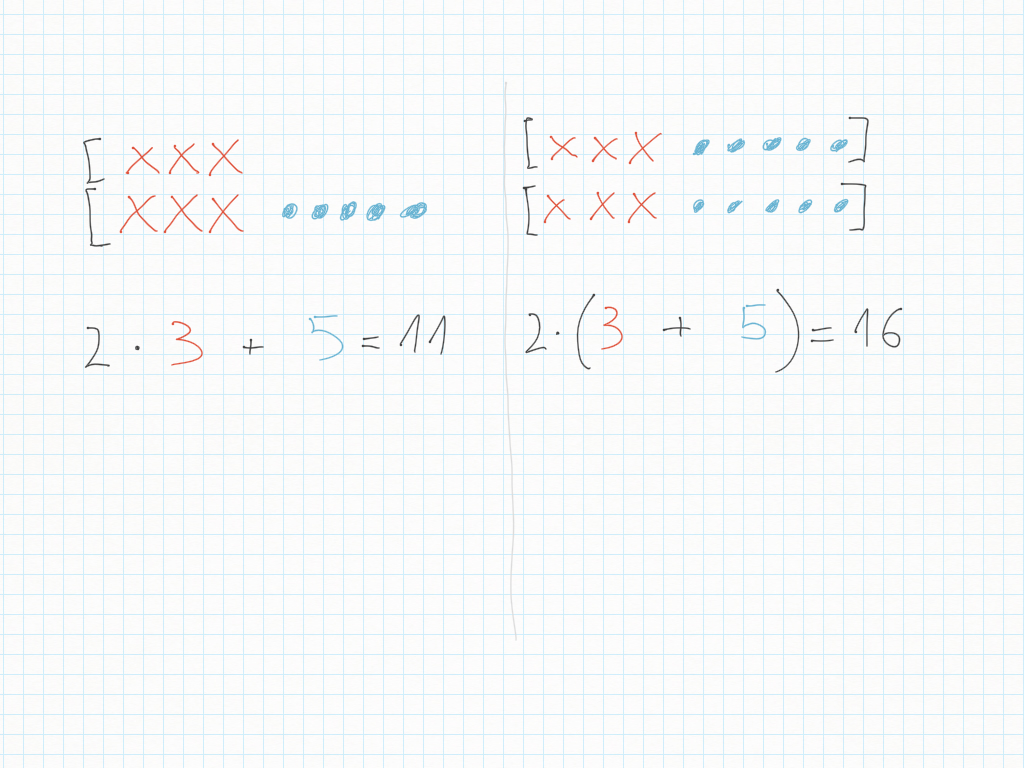


9 Ottobre
Nell'esperimento del filmato abbiamo potuto vedere che i risultati cambiano a seconda delle condizioni sperimentali:
- nel vuoto la caduta non dipende dal peso;
- in presenza dell'aria la caduta può essere rallentata.
Vediamo degli altri esperimenti di caduta di oggetti (in questo video https://yewtu.be/watch?v=FDvcIuNEgo0):

- la velocità di caduta/discesa non dipende dal materiale;
- la velocità dipende piuttosto dalla forma ma non dalla dimensione;
Filmato per il compito: https://yewtu.be/watch?v=pf4u8JfvQ3c
5 Ottobre
https://telegra.ph/1C---5-ottobre-10-05
3 Ottobre
Il lavoro degli scienziati e i loro strumenti
Non è facile descrivere questo lavoro e come le conoscenze scientifiche procedano/avanzino, ma qualcosa possiamo dire:
- si cerca di isolare un fenomeno attraverso un esperimento;
- si misurano delle grandezze;
- si cercano delle regolarità;
Per esempio: far cadere degli oggetti nel vuoto significa isolare il fenomeno della caduta rispetto alla presenza dell'aria;
https://yewtu.be/watch?v=E43-CfukEgs
26 Settembre
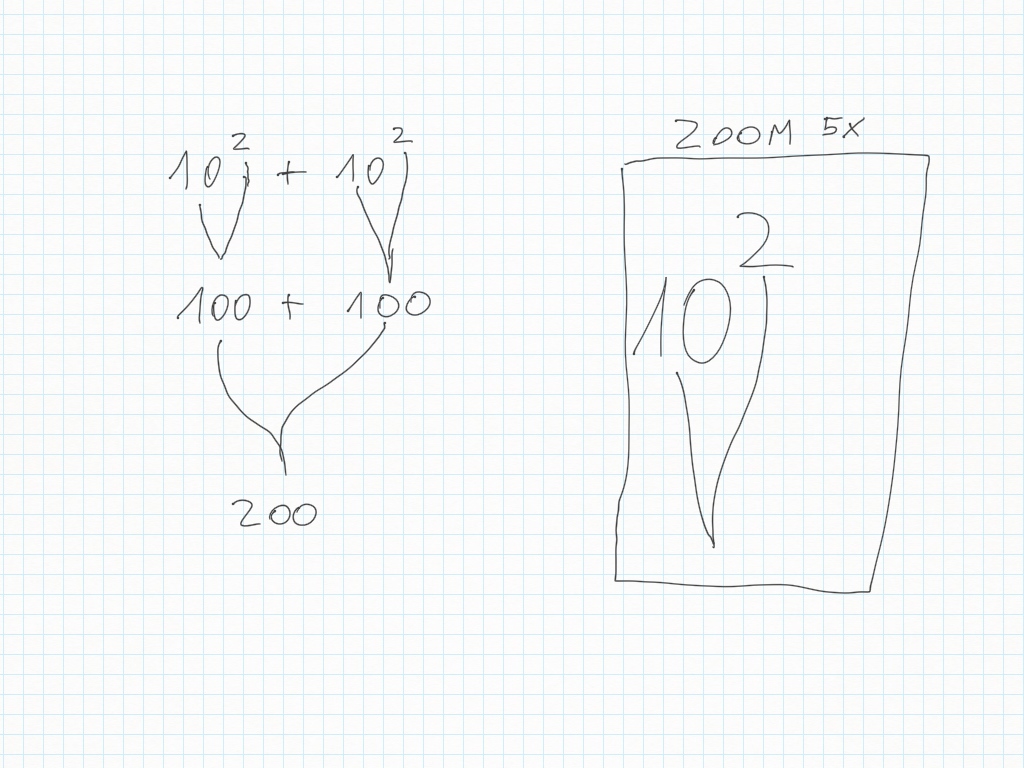
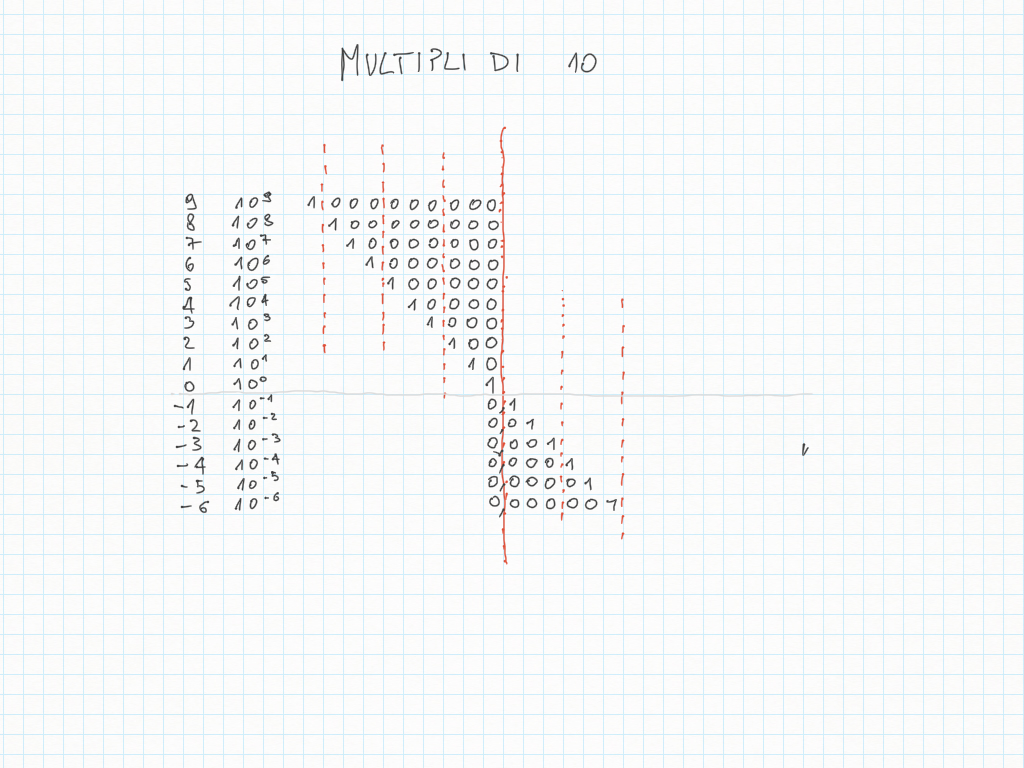
Le potenze di dieci
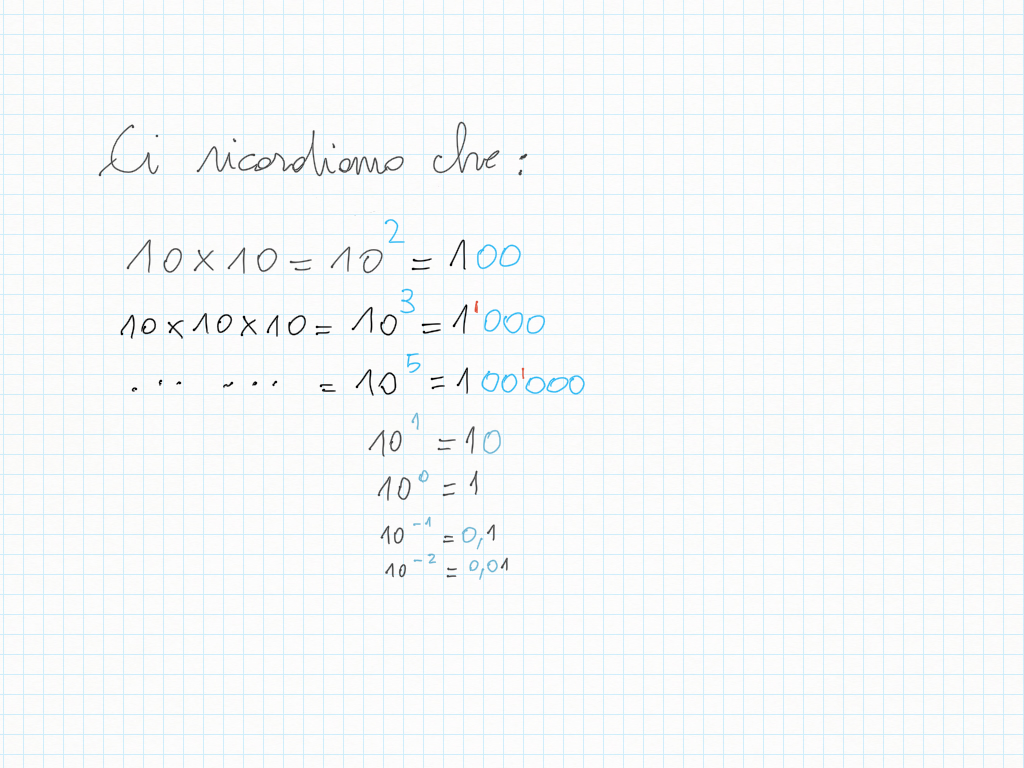

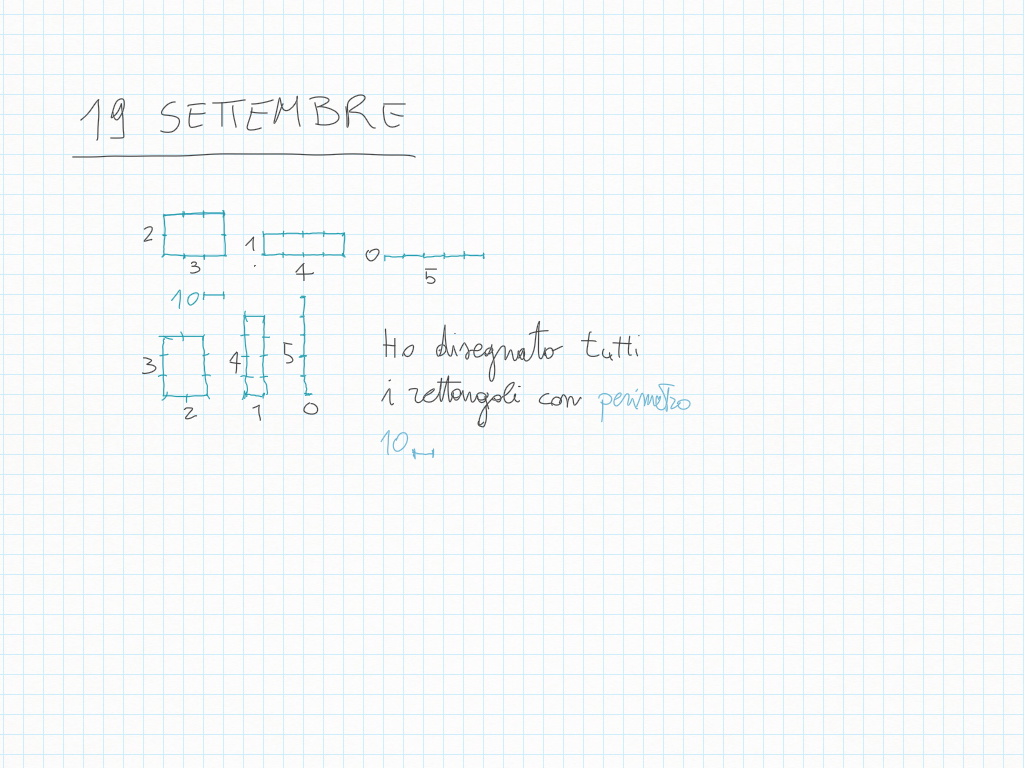
19 Settembre
Disegna tutti i rettangoli che hanno perimetro di 10 quadretti
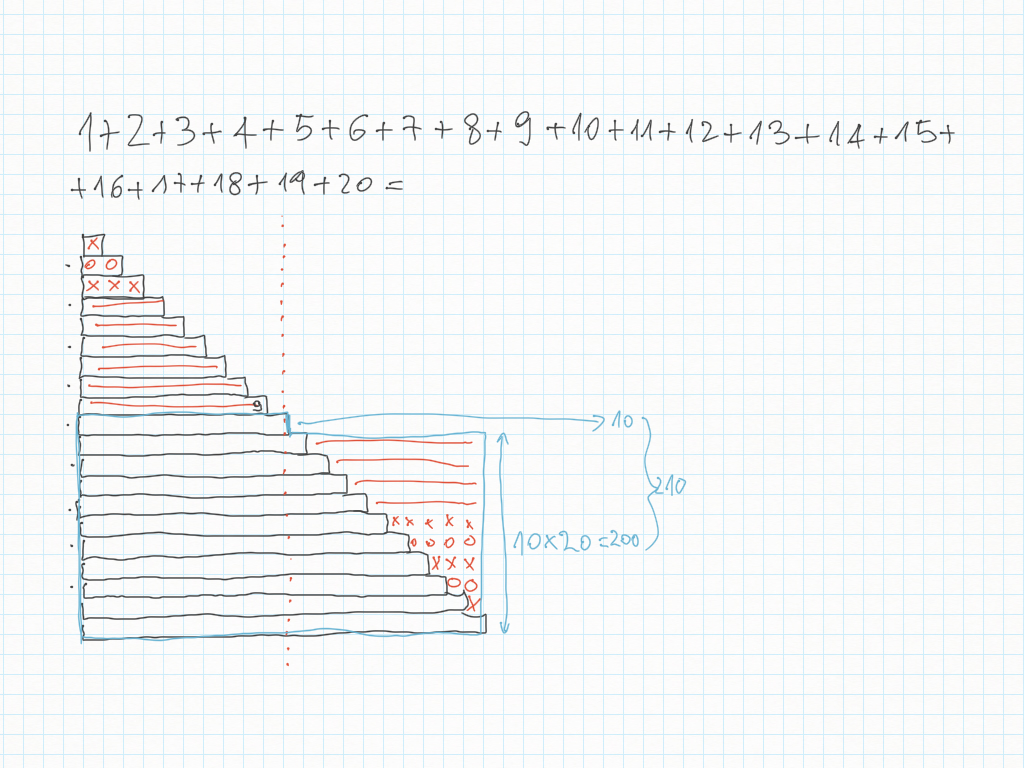
18 Settembre
La somma dei primi 20 numeri
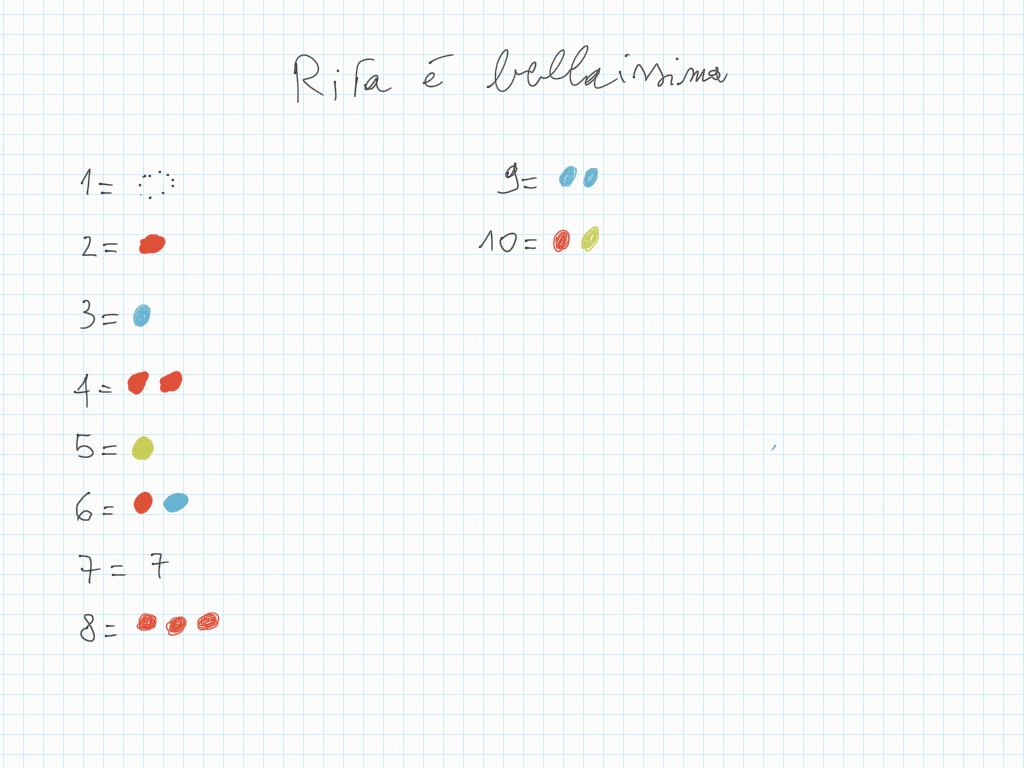
Tutte le coppie di addendi che sommano a 8